Najlepsze pytania
Chronologia
Czat
Perspektywa
Tlenki węgla
każdy binarny związek węgla i tlenu Z Wikipedii, wolnej encyklopedii
Remove ads
Tlenki węgla – związki chemiczne składające się z węgla i tlenu[a].
Najprostsze i spotykane powszechnie tlenki węgla to tlenek węgla (CO) i dwutlenek węgla (CO2). Poza nimi znanych jest wiele innych trwałych lub metatrwałych tlenków węgla, np. tzw. podtlenek węgla (ditlenek triwęgla, O=C=C=C=O) odkryty przez Brodiego w 1873 roku[4] i bezwodnik melitowy (C12O9) opisany przez Meyera i Steinera w 1913 roku[5][6][7]. W roku 1859 Brodie opisał też tzw. tlenek grafitu[8], który jednak według współczesnej wiedzy zawiera także liczne grupy hydroksylowe[9] (z tlenku grafitu można uzyskać tlenek grafenu o jednowarstwowej strukturze analogicznej do grafenu[9]).
 | |||||||
| CO Tlenek węgla |
CO2 Dwutlenek węgla |
C3O2 Podtlenek węgla |
C12O9 Bezwodnik melitowy |
Przez wiele dziesiątków lat te związki były powszechnie uważane za jedyne trwałe tlenki węgla. Jednak od lat 60. XX wieku utworzono nowe związki, z których część była trwała w temperaturze pokojowej. Niektóre były metatrwałe lub trwałe tylko w bardzo niskich temperaturach i rozkładały się na prostsze po ogrzaniu. Wiele było nietrwałych, które mogły być obserwowane jako etapy przejściowe reakcji chemicznych, lub tak reaktywnych, że mogły istnieć tylko w fazie gazowej lub w warunkach izolacji matrycowej. Ważne przykłady tych ostatnich to monotlenek diwęgla (rodnik: C=C=O), tritlenek węgla (CO3)[10] i 1,2-dioksoetandion (C2O4)[11][12]. Niektóre z tych reaktywnych tlenków węgla zostały wykryte w obłokach molekularnych w przestrzeni międzygwiazdowej dzięki spektroskopii rotacyjnej[13].
Wiele hipotetycznych tlenków węgla badano metodami teoretycznymi, np. bezwodnik szczawiowy (C2O3 albo O=(C2O)=O), etylenodion (C2O2 albo O=C=C=O)[14] i inne liniowe lub pierścieniowe polimery tlenku węgla (−C(=O)–)n (poliketony)[15] oraz liniowe i pierścieniowe polimery dwutlenku węgla −(O−C(=O)–)n, jak dimer 1,3-dioksetanodion (C2O4)[16] i trimer 1,3,5-trioksanotrion (C3O6)[16][17].
 |
 |
 |
|||||||
| C2O3 Bezwodnik szczawiowy |
C2O4 1,2-Dioksetano- dion |
C2O4 1,3-Dioksetano- dion |
C3O6 1,3,5-Trioksano- trion |
C2O2 Etyleno- dion |
Liczba znanych tlenków węgla wciąż rośnie. Istnienie tlenku grafitu i innych trwałych polimerycznych tlenków węgla o nieograniczonej strukturze molekularnej[18][8] sugeruje, że wiele innych pozostało do odkrycia.
Remove ads
Liniowe dwutlenki węgla
Liniowe dwutlenki węgla tworzą szereg homologiczny o wzorze ogólnym CnO2 lub O=(C=)nO. Zbudowane są z prostego łańcucha atomów węgla połączonych skumulowananymi wiązaniami podwójnymi i zakończonego na obu końcach atomami tlenu. Pierwsi przedstawiciele szeregu to
- CO2 albo O=C=O, dwutlenek węgla.
- C2O2 albo O=C=C=O, skrajnie nietrwały etylenodion[14].
- C3O2 albo O=C=C=C=O, metatrwały podtlenek węgla albo ditlenek triwęgla.
- C4O2 albo O=C=C=C=C=O, ditlenek tetrawęgla albo 1,2,3-butatrien-1,4-dion[19]
- C5O2 albo O=C=C=C=C=C=O, ditlenek pentawęgla[20], trwały w roztworze w temperaturze pokojowej, a w postaci czystej poniżej −90 °C[21].
Wyższe człony tego szeregu odkryto w ilościach śladowych w gazach pod niskim ciśnieniem lub eksperymentach z macierzami kriogenicznymi, zwłaszcza dla n = 7[21] oraz n = 17, 19 i 21[22].
Remove ads
Liniowe monotlenki węgla
Inną grupą tlenków węgla są liniowe tlenki węgla CnO. Pierwszy członek, zwykły tlenek węgla CO, wydaje się być jedynym trwałym w stanie czystym w temperaturze pokojowej. Fotoliza liniowych dwutlenków węgla w macierzy kriogenicznej prowadzi do utraty CO i powstania wykrywalnych ilości jednotlenków o parzystej liczbie atomów węgla takich jak C2O, C4O[23] i C6O[21]. Człony do n = 9 uzyskano też przy wyładowaniach elektrycznych w gazowym C3O2 wymieszanym z argonem[24]. Pierwsze trzy człony szeregu obserwowano w przestrzeni międzygwiezdnej[24].
Uważa się, że kiedy n jest parzyste, cząsteczki są w stanie trypletowym (jak kumuleny), z atomami połączonymi wiązaniami podwójnymi i niezapełnionym orbitalem pierwszego węgla – jak w: C=C=O: C=C=C=C=O i ogólnie: (C=)n=O. Kiedy n jest nieparzyste, struktura trypletowa jest prawdopodobnie w rezonansie z singletową (jak w acetylenie) polarną strukturą z ładunkiem ujemnym na końcu węglowym i dodatnim na atomie tlenu, jak w −+C≡C−C≡O, −+C≡C−C≡C−C≡O i ogólnie −(C≡C–)n/2C≡O+[24]. Tlenku węgla też dotyczy ta struktura: za dominującą formę jest uważana −+C≡O[25].
Remove ads
Cykliczne radialenowe tlenki węgla
Podsumowanie
Perspektywa
Inną interesującą rodziną tlenków węgla są cykliczne radialenowe tlenki CnOn albo (CO)n[26]. Mogą być uważane za pierścieniowe polimery tlenku węgla lub n-krotne ketony n-węglowych cykloalkanów. Pierwsze dwa człony to sam tlenek węgla (CO) i skrajnie nietrwały etylenodion C2O2 albo O=C=C=O[14]. Teoretyczne analizy sugerują, że następne cztery człony szeregu – C3O3, C4O4, C5O5 i C6O6 – mogą być trwałe, ale dotąd udało się je wytworzyć tylko w śladowych ilościach[27].
 |
 |
 |
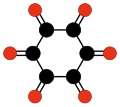 | ||||
| (CO)3 Cyklopropano- trion |
(CO)4 Cyklobutano- tetron |
(CO)5 Cyklopentano- penton |
(CO)6 Cykloheksano- hekson |
Z drugiej strony aniony tych związków są dość stabilne, a niektóre z nich są znane od XIX wieku[26]. Są to:
- C2O2−2, anion acetylenodiolowy (Weiss i Büchner, 1963)[28]
- C3O2−3, anion kwasu deltowego (dihydroksycyklopropanonu; Eggerding i West, 1976)[29][30],
- C4O2−4, anion kwasu kwadratowego (1,2-dihydroksycyklobutano-3,4-dionu; Cohen i inni, 1959)[31]
- C5O2−5, anion kwasu krokonowego (1,2-dihydroksycyklopentano-3,4,5-trionu; Gmelin, 1825)[32]
- C6O2−6, anion kwasu rodyzonowego (1,2-dihydroksycykloheksano-3,4,5,6-tetronu; Heller, 1837)[33][34].
Tlenek C6O6 tworzy też trwałe aniony tetrahydroksybenzochinonu (C6O4−6) i heksahydroksybenzenu (C6O6−6)[35]. Aromatyczność tych anionów była badana metodami teoretycznymi[36][37].
Nowe tlenki
Podsumowanie
Perspektywa
Wiele nowych trwałych i metatrwałych tlenków otrzymano począwszy od lat 60. XX wieku. Należą do nich:
- C12O12 albo C6(C2O4)3, tris(szczawian) heksahydroksybenzenu (1967); trwały jako solwat tetrahydrofuranu[38].
- C10O10 albo C6O2(C2O4)2, bis(szczawian) tetrahydroksy-p-benzochinonu (1968); trwały jako solwat tetrahydrofuranu[39]
- C8O8 albo C6O2(CO3)2, bis(węglan) tetrahydroksy-p-benzochinonu (1984); rozkłada się w temperaturze około 45–53 °C[40].
- C9O9 albo C6(CO3)3, tris(węglan) heksahydroksybenzenu (1984); rozkłada się w temperaturze około 45–53 °C[40].
- C24O6 i C32O8, odpowiednio pierścieniowy trimer i tetramer podwójnego rodnika, 3,4-dialkinylo-3-cyklobuteno-1,2-dionu −C≡C−(C4O2)−C≡C− (1990)[41]
- C4O6, dioksanotetron albo dimer bezwodnika szczawiowego (1998); trwały w Et2O w temperaturze −30 °C, rozkłada się w temperaturze 0 °C[42].
- C12O6, heksaoksotricyklobutabenzen (2006)[43][44]
Remove ads
Polimeryczne tlenki węgla
Podtlenek węgla (O=C=C=C=O) ulega spontanicznej polimeryzacji do ciała stałego o żółtym lub brązowym zabarwieniu[45], zarówno z fazy gazowej (tworzy barwne filmy na ściankach naczynia), jak i z roztworu (ciemnobrązowy precypitat)[18]. Badania spektroskopowe, rentgenograficzne i analiza rozkładu termicznego sugerują, że polimer zbudowany jest ze skumulowanych sześcioczłonowych pierścieni α-pironu (walerolaktonu). Pomiary fizyczne wskazują, że średnia liczba merów w cząsteczce wynosi około 5–6, zależnie od temperatury tworzenia[18][46]. W substancji stwierdzono występowanie szeregu oligomerów[18]:
 |
 |
 |
 | ||||||
| Oligomery C3O2 o 3–6 jednostkach. | |||||||||
Innym polimerem węglowotlenowym, o stosunku C:O wynoszącym 5:1 lub więcej, jest klasyczny tlenek grafitu[8] i jego jednowarstwowa postać tlenek grafenu.
Remove ads
Uwagi
- W literaturze anglojęzycznej funkcjonuje termin oxocarbons (analogicznie w niektórych innych językach) oznaczający wg IUPAC związki zbudowane wyłącznie z węgla i tlenu[1]. Został on wprowadzony w roku 1963 przez Roberta Westa i Davida L. Powella[2][3]. West definiuję tę nazwę nieco inaczej niż IUPAC, jako związki, w których wszystkie lub prawie wszystkie atomy węgla tworzą układy karbonylowe (C=O) lub enolowe (C=C–OH), lub ich formy hydratowane lub deprotonowane[2]. W polskiej nomenklaturze chemicznej analogiczny termin nie jest stosowany.
Remove ads
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads








