Лучшие вопросы
Таймлайн
Чат
Перспективы
Хлорид аммония
соль аммония Из Википедии, свободной энциклопедии
Remove ads
Хлори́д аммо́ния (хло́ристый аммо́ний; техническое название — нашаты́рь) — неорганическое соединение, соль аммония и соляной кислоты с химической формулой белый кристаллический слегка гигроскопичный порошок без запаха. Хорошо растворяется в воде. Не образует кристаллогидратов. Зарегистрирован в качестве пищевой добавки E510.
Remove ads
Нахождение в природе

В природе хлорид аммония представлен минералом нашатырь, от араб. ﻧﺸﺎﺩﺭ (nūšādir) — «аммиак»[4].
Природный раствор хлорида аммония, находящийся в целоме, обеспечивает нейтральную плавучесть гигантских планктонных кальмаров — кранхиид и других крупных кальмаров так как водный раствор хлорида аммония в теле кальмаров имеет плотность ниже плотности морской воды[5][6].
Remove ads
Физические свойства
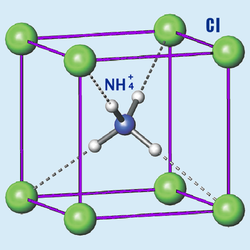
Бесцветные или белые кристаллы кубической сингонии (а = 0,38758 нм, z = 1, пространственная группа Pm3m). Относительная плотность = 1,526. Кубическая модификация стабильна ниже температуры 184,3 °C. Соединение возгоняется при 337,6 °C с разложением на аммиак и соляную кислоту[7][8] (правильнее: хлороводород или хлористый водород HCl).
Хорошо растворим в воде (37,2 г/100 мл), жидком аммиаке. Водные растворы вследствие гидролиза имеют слабокислую реакцию. Температура кипения насыщенных водных растворов 116 °C[7].
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г.
Remove ads
Химические свойства
Суммиров вкратце
Перспектива
Реагирует со щелочами с выделением аммиака[8]:
- .
Реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света[8]:
- .
Реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
- .
Под действием электрического тока разлагается с образованием хлористого азота .
Remove ads
Получение
Суммиров вкратце
Перспектива
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия (промежуточный продукт при получении соды по методу Сольве):
- .
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор хлорида натрия .
Иногда используют реакцию взаимодействия аммиака с хлором:
- .
Реакция взаимодействия аммиака и соляной кислоты:
- .
Remove ads
Применение
- азотное удобрение (до 25 % азота) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках, вызванных сердечной недостаточностью и для усиления действия диуретиков;
- в лабораторных технологиях для лизиса эритроцитов;
- как дымообразователь;(обратимо разлагается при нагреве на хлороводород и аммиак — трудноразделимую подвижную смесь газов, которая при остывании снова образует микрокристаллический порошок хлорида аммония в виде дыма, малоопасного для человека и животных.
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе[9].
Remove ads
Примечания
Литература
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads