Лучшие вопросы
Таймлайн
Чат
Перспективы
Соляная кислота
раствор хлороводорода в воде Из Википедии, свободной энциклопедии
Remove ads
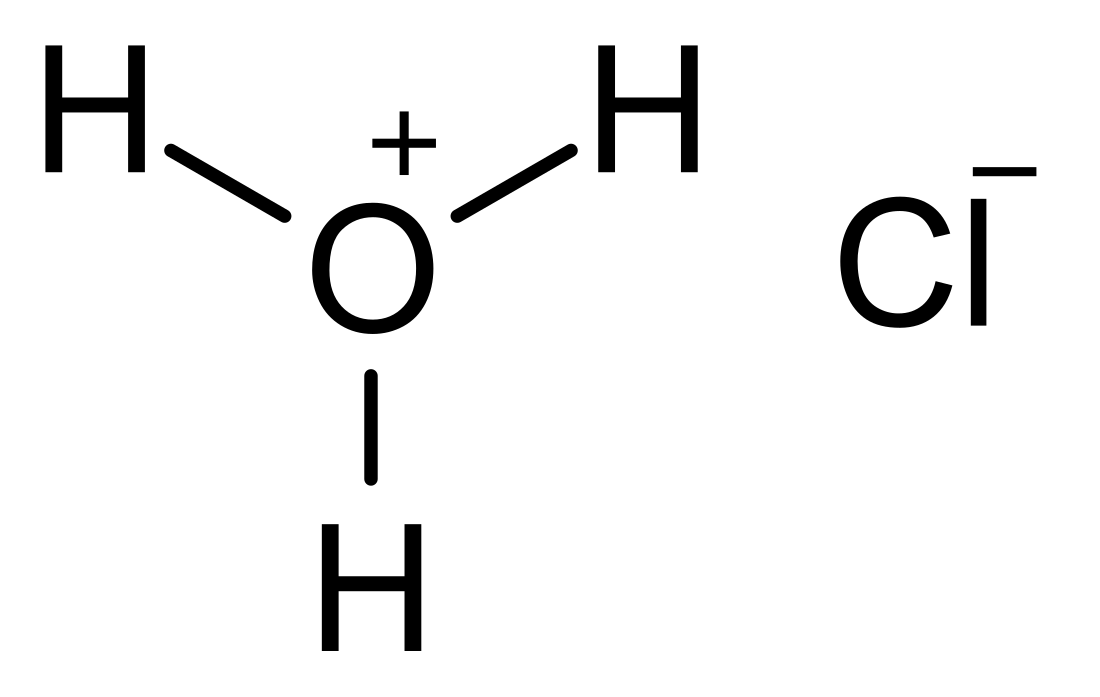
Соля́ная кислота́ (также хлороводоро́дная, или хлористоводоро́дная кислота, химическая формула — HCl) — сильная неорганическая кислота. Раствор хлороводорода в воде.
При стандартных условиях это сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
Remove ads
История
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII веке получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[6].
Remove ads
Физические свойства
Суммиров вкратце
Перспектива
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
При 20 °C, 1 атм (101,325 кПа)
Хлороводород хорошо растворим в воде. Так, при 0 °C один объём воды может поглотить 507 объёмов , что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость ниже, поэтому на практике обычно используют соляную кислоту с концентрацией от 35 до 38% масс.
При низкой температуре хлороводород с водой даёт кристаллогидраты составов (температура плавления −15,4 °С), (температура плавления −18 °С), (температура плавления −25 °С), (температура плавления −70 °С). При атмосферном давлении (101,325 кПа) хлороводород с водой образуют азеотропную смесь с температурой кипения 108,6 °С и содержанием 20,4 мас. %[7].

Remove ads
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
- ,
- ,
- .
- ,
- ,
- .
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- ,
- ,
- .
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например, угольной кислотой:
- .
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
- .

- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристаллов хлорида аммония[8]:
- .
- Качественная реакция на соляную кислоту и её соли — взаимодействие кислоты с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[9]:
- Смесь концентрированных соляной и азотной кислотой, именуемая царской водкой, обладает очень сильными окисляющими свойствами и используется в лабораториях для очистки оборудования. Также, эта смесь способна растворять золото и иные благородные металлы:
- ,
- ,
- .
Remove ads
Получение
Суммиров вкратце
Перспектива
Соляную кислоту получают растворением газообразного хлороводорода (HCl) в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической.
Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется для получения реагента высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на твёрдую поваренную соль:
- .
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- .
Получение путём гидролиза хлоридов магния, алюминия (производится нагревание гидратированной соли):
- ,
- .
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
Помимо этого, соляная кислота может быть получена при помощи обменных реакций её солей с другими кислотами. Например, при добавлении серной кислоты к раствору хлорида кальция или бария и дальнейшем фильтровании осадка. В первом случае в растворе будет некоторая примесь сульфата кальция, который значительно более растворим в воде по сравнению с сульфатом бария:
Remove ads
Применение

Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и других металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (для этих целей необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления сельтерской (содовой) воды.
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
В быту
- Соляная кислота продаётся как средство для удаления известкового налёта на керамических и иных поверхностях. При её реакции с очень плохо растворимым в воде карбонатом кальция и карбонатом магния образуются хорошо растворимые хлориды, например, реакция с карбонатом кальция:
- .
Remove ads
Особенности обращения



Соляная кислота относится к веществам III класса опасности[5]. Рекомендуемая ПДК в рабочей зоне — 5 мг/м³[4].
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно пищевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, образуют туман с влагой воздуха, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия), образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[11].
Remove ads
Примечания
Ссылки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





![{\displaystyle {\mathrm {HCl} \,{\cdot }\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/5638d57dc7a509a79161264cd9c8f00c65514b23)
![{\displaystyle {\mathrm {HCl} \,{\cdot }\,2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1e867e5e27346e8b2afecd1cd73434bc5187d09e)
![{\displaystyle {\mathrm {HCl} \,{\cdot }\,3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/055694595d927223276a1622e52d6f151dd676ac)
![{\displaystyle {\mathrm {HCl} \,{\cdot }\,6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b17d7ab25cac308424025eb0a279f14dcaacbc70)
![{\displaystyle {2\,\mathrm {Li} {}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}2\,\mathrm {LiCl} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8ee0270f31dd65d3f24103d040e4fc325131672c)
![{\displaystyle {\mathrm {Mg} {}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {MgCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/98e6a8b4e11f5175b8d8f11e461c416bb8af7729)
![{\displaystyle {2\,\mathrm {Al} {}+{}6\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}2\,\mathrm {AlCl} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/6292423e409adafd9492a5d3f440560ffa6d1d06)
![{\displaystyle {\mathrm {Li} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}2\,\mathrm {LiCl} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3c1633144118d55497400669e27c30e275035234)
![{\displaystyle {\mathrm {MgO} {}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {MgCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/91744d461c509c3350a007525d5fc57d1a43f390)
![{\displaystyle {\mathrm {Al} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}6\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}2\,\mathrm {AlCl} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/961a31767db71b6a5162141d18f2181a0673a8db)
![{\displaystyle {\mathrm {NaOH} {}+{}\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {NaCl} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/61be6dd9efc0dd7f03d62470fedfdd09aee92e62)
![{\displaystyle {\mathrm {Ba} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {BaCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8d473454f4483d530b6059885e430ccbd6380217)
![{\displaystyle {\mathrm {Al} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {AlCl} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/be3fffa75de8f53923594c07afaf7bf69fc93d9b)
![{\displaystyle {\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}2\,\mathrm {NaCl} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/07b737281c0501323590b8f5eaf5278577a1801a)
![{\displaystyle {2\,\mathrm {KMnO} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}16\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}5\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}{}+{}2\,\mathrm {MnCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {KCl} {}+{}8\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f135713fae21d7dd5a39c83ae07d4ed8f37d93b2)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/abe4f77d49f9ce80eab4677434b39a88f48da261)
![{\displaystyle {\mathrm {HCl} {}+{}\mathrm {AgNO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {AgCl} \downarrow {}{}+{}\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bcc7007f9b0cd1cefaf94008c1fbef6a2bfca5de)
![{\displaystyle {3\,\mathrm {HCl} {}+{}\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightleftharpoons } {}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {NOCl} {}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/eec3603b00df8afd3447fb0f6e11efe1c59c31e7)
![{\displaystyle {\mathrm {Au} {}+{}3\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}4\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {H} [\mathrm {AuCl} {\vphantom {A}}_{\smash[{t}]{4}}]{}+{}3\,\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/51ceba8c0d850dcb6c52c642c956fec2d8949f64)
![{\displaystyle {\mathrm {Pt} {}+{}4\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}6\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}[\mathrm {PtCl} {\vphantom {A}}_{\smash[{t}]{6}}]{}+{}4\,\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}4\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d3583dbf56d03686e90be97332ba656ddf240e25)
![{\displaystyle {\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {HCl} \uparrow {}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/dd4de27c43bda00a8172949170f29e259d55f7ef)
![{\displaystyle {\mathrm {NaCl} \ {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\xrightarrow {150~{\vphantom {A}}^{\circ }{\text{C}}} } {}\mathrm {NaHSO} {\vphantom {A}}_{\smash[{t}]{4}}\ {}+{}\mathrm {HCl} \uparrow }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/31c500c5efd09073bccc057fd23c8deb9d6fc626)
![{\displaystyle {2\,\mathrm {NaCl} \ {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\xrightarrow {550~{\vphantom {A}}^{\circ }{\text{C}}} } {}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}\ {}+{}2\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/abc573c441548e6d496e060dcdb41811744f5651)
![{\displaystyle {\mathrm {MgCl} {\vphantom {A}}_{\smash[{t}]{2}}\,{\cdot }\,6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow {\mathrm {t} {,}{\mkern {3mu}}~{\vphantom {A}}^{\circ }{\text{C}}} } {}\mathrm {MgO} \ {}+{}2\,\mathrm {HCl} \ {}+{}5\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/24925dc7c0762665130fe80c78ff44d845e9b6da)
![{\displaystyle {\mathrm {AlCl} {\vphantom {A}}_{\smash[{t}]{3}}\,{\cdot }\,6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow {\mathrm {t} {,}{\mkern {3mu}}~{\vphantom {A}}^{\circ }{\text{C}}} } {}\mathrm {Al} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}3\,\mathrm {HCl} \ {}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f7fb3020a9dede930d68ce1259759acbf733375d)
![{\displaystyle {2\,\mathrm {MgCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {Mg} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {OCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7e2235580de2af9e8b8cd392828f10187347ca07)
![{\displaystyle {\mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {CaSO} {\vphantom {A}}_{\smash[{t}]{4}}\downarrow {}{}+{}2\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/71132d903352558eb4e29bf37f24b0f71e418db3)
![{\displaystyle {\mathrm {BaCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {BaSO} {\vphantom {A}}_{\smash[{t}]{4}}\downarrow {}{}+{}2\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/20190e4dc344d9568b735f4a1041a276d394355f)
![{\displaystyle {\mathrm {CaCO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}2\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}\uparrow {}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/6e7056e32af5cce1e4ead181fdad816cdd74a881)