Лучшие вопросы
Таймлайн
Чат
Перспективы
Хлорная кислота
химическое соединение, одна из самых сильных неорганических кислот Из Википедии, свободной энциклопедии
Remove ads
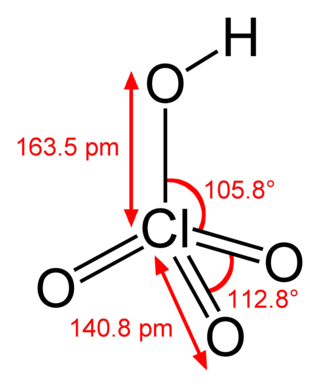
Хло́рная кислота́ (хим. формула — HClO4) — сильная одноосновная кислота.
Безводная кислота является исключительно сильным окислителем, так как содержит хлор в высшей степени окисления +7.
Remove ads
Свойства
Суммиров вкратце
Перспектива
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора(VII). Водные растворы с концентрацией ниже 72 % более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавить и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы:
а в реакции с серебром образует хлорноватую кислоту:
Концентрированная хлорная кислота растворяет практически все металлы, исключение составляет только чистый иридий, свежеосажденная иридиевая чернь в хлорной кислоте растворяется.
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
- (данная реакция используется в металлургии для очистки руд.
Аммиак окисляется в концентрированной хлорной кислоте до азотной кислоты:
В отличие от других кислот, хлорная при этом не образует соответствующей соли аммония.
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, иодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4−, NO2+ClO4−.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Их большинство растворимо в воде. Малорастворимы перхлораты калия, цезия и рубидия. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Перхлорилфторид можно получить прямым синтезом:
Remove ads
Получение
Суммиров вкратце
Перспектива
- Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами. При взаимодействии перхлоратов с серной кислотой образуется оксид хлора (VII) :
- Для получения безводной хлорной кислоты требуется нагрев насыщенного раствора перхлората аммония с добавлением азотной, а затем и соляной кислоты, вследствие чего образуется хлорная кислота, вода, хлор и оксид азота (I):
Для получения особо чистого оксида хлора семь требуется нагрев сухих хлоратов металлов с жидким фторидом кислорода:
Remove ads
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется как окислитель в производстве пиротехнических составов и порохов, перхлорат магния (ангидрон) — осушитель, перхлорат аммония — окислитель в твердых смесевых ракетных топливах (в сочетании с восстановителями - как правило, полимером, служащим связующим (например, полиуретаном), и порошковым металлом (обычно алюминием), увеличивающим температуру и скорость горения), взрывчатое вещество.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М., 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads