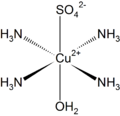Хемијска формула
Компактна нотација хемијских једињења From Wikipedia, the free encyclopedia
Remove ads
Хемијска формула или молекулска формула је формула која показује врсту и број атома који чине неки молекул. Молекулске формуле су ознаке хемијских једињења, облик приказивања њихових молекула; поред квалитативног састава, оне показују и квантитативни однос атома који сачињавају молекул хемијског једињења. Формуле се изражавају хемијским знацима; нпр. молекул хемијског једињења воде састављен је од два атома водоника и једног атома кисеоник, па је молекулска формула воде . Поред тога, молекулске формуле, на основу познатих атомских маса и валентности, показују однос маса атома који изграђују једињења (у овом случају 18 грама воде састоји се од 2 грама водоника и 16 грама кисеоника).


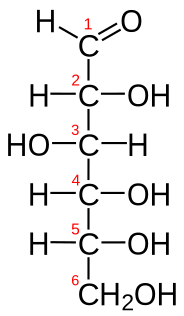
Молекулске формуле не показују унутрашњу структуру молекула, па се зато, нарочито у органској хемији, примењују рационалне формуле и структурне формуле. Рационалним формулама се, у ствари, скраћеним начином показује како су повезани атоми у молекулу нпр. молекулска формула етил-алкохола је , док ће његова рационална формула бити . Структурне хемијске формуле показују, поред квалитативног и квантитативног састава молекула једног хемијског једињења, још и начин на који су атоми и атомске групе у молекулима међусобно повезани. Структурна формула етил-алкохола изгледа овако:
Remove ads
Преглед
Хемијска формула је један од начина представљања информација о хемијским пропорцијама атома који чине одређено хемијско једињење или молекул, користећи симболе хемијских елемената, бројеве, а понекад и друге симболе, попут уметања, цртица, заграда, зареза и знакова плус (+) и минус (–). Они су ограничени на једну типографску линију симбола, која може укључивати индексе и натписе. Хемијска формула није хемијски назив и не садржи речи. Иако хемијска формула може подразумевати одређене једноставне хемијске структуре, то није исто што и пуна хемијска структурна формула. Хемијске формуле могу у потпуности одредити структуру само најједноставнијих молекула и хемијских супстанци, и углавном су ограниченије снаге од хемијских имена и структурних формула.
Најједноставније врсте хемијских формула називају се емпиријске формуле, које користе слова и бројеве који означавају нумеричке пропорције атома сваке врсте. Молекулске формуле означавају једноставне бројеве сваке врсте атома у молекулу, без података о структури. На пример, емпиријска формула за глукозу је (двоструко више атома водоника од угљеника и кисеоника), док је његова молекулска формула.
Хемијска формула је запис састава хемијског једињења помоћу хемијских симбола. Хемијска формула може бити:
- Емпиријска формула, која наводи елементе једињења у њиховом међусобном односу. Пример: ; у једињењу означава однос водоника и угљеника 1:2. Једињења с таквим саставом су обично велика, нпр. сви алкени или циклоалкани.
- Структурна формула, која уз однос појединог једињења наводи валенцију и распоред атома у молекулу.
- Молекулска формула, која наводи број атома елемента у поједином једињењу. Пример: бутан -
Remove ads
Дефиниција
Хемијска формула је један од начина представљања информација о хемијским пропорцијама атома који чине одређено хемијско једињење или молекул, користећи симболе хемијских елемената, бројеве, а понекад и друге симболе, попут уметања, цртица, заграда, зареза и знакова плус (+) и минус (–). Они су ограничени на једну типографску линију симбола, која може укључивати индексе и натписе. Хемијска формула није хемијски назив и не садржи речи. Иако хемијска формула може подразумевати одређене једноставне хемијске структуре, то није исто што и пуна хемијска структурна формула. Хемијске формуле могу у потпуности одредити структуру само најједноставнијих молекула и хемијских супстанци, и углавном су ограниченије снаге хемијских имена и структурних формула.[1][2]
Најједноставније врсте хемијских формула називају се емпиријске формуле, које користе слова и бројеве који означавају нумеричке пропорције атома сваке врсте. Молекулске формуле означавају једноставне бројеве сваке врсте атома у молекулу, без података о структури. На пример, емпиријска формула за глукозу је (двоструко више атома водоника од угљеника и кисеоника), док је његова молекулска формула.
Тако нпр. формула означава молекул воде, која се састоји од двају атома водоника () и једног атома кисеоника (O).
Формулска јединица
Формулску јединица је најмањи однос броја анјона и катјона у јонском једињењу који се приказује формулом једињења. Јонска материја је огроман скуп анјона и катјона који су повезани јонском везом (електростатском). У јонској материји наизменично су распоређени анјони и катјони, односно сваки анјон је окружен одређеним бројем катјона и обрнуто. Не постоји молекул јонског једињења већ је цело једињење један „велики молекул”. Зато формула јонског једињења има само најмањи однос броја анјона и катјона у једињењу, односно приказује формулску јединку. Формула 2 говори да се у калцијум хлориду катјони (2+) и анјони (–) налазе у односу 1:2 те је 2 формулска јединка калцијум хлорида.[3][4]
У најширем смислу свака формула представља формулску јединку.
Формуле хидратних соли
Кристали хидратних соли имају у саставу везану кристалну воду. Формула једињења се пише, на пример: . Тачка у формули не представља знак множења већ је знак сабирања (плус). Вода је уклопљена у кристалну структуру једињења. Написана формула је сажети облик писања. Заправо формулу би правилније требало писати као: . Четири молекула воде се координирају с јоном бакра, док је пети молекул воде повезан са сулфатним јоном. Такође, заправо је . Угласте заграде у писању користе се за креирање формула комплексних једињења.
Формуле комплексних једињења
Формуле комплексних једињења, сажето се пишу као у претходним примерима, али најпризорније је формулу приказати „тродимензионо”.
- Бакар тетрааминосулфат хидтат
- Родијум пентаминотрихлорид [Rh(NH3)5Cl]Cl2
Remove ads
Типови хемијских формула
Хемијске формуле разликују се према информацијама које пружају.
- Формула елементарне материје предочава молекул односно скуп истоврсних атома који се налазе у молекулу елементарне материје ()
- Емпиријска формула показује само релативне односе броја појединих атома у јединки, а одређује се на темељу масених удела појединих елемената у споју добивених елементарном анализом.
- Молекулска формула показује тачан број атома у једињењу (молекули), а одређује се из емпиријске формуле и познате молекулске масе.
- Структурна формула приказује начин повезивања атома у молекулу, а одређује се након идентификације функционалних група молекула (алкохолна, алдехидна, киселинска, аминска и друго), најчешће спектроскопским техникама.
- Сажета структурна формула је структурна формула написана једноставније, често у једном реду, приказане су атомске групе и атоми али начин њиховог повезивања није потпуно јасан.
- Стереохемијска формула приказује просторну оријентацију атома у молекулу различитим типовима пројекција које укључују многе додатне конвенције. Просторни распоред атома непосредно се одређује дифракцијским методима структурне анализе.
Закон о композицији
У било ком датом хемијском једињењу, елементи се увек међусобно комбинују у истој пропорцији. Ово је закон сталних односа маса.
Закон константног састава наводи да ће се у било ком одређеном хемијском једињењу сви узорци тог једињења састојати од истих елемената у истој пропорцији или односу. На пример, било који молекул воде се увек састоји од два атома водоника и једног атома кисеоника у односу 2: 1. Ако се погледају релативне масе кисеоника и водоника у молекулу воде, види се да 94% масе молекула воде чини кисеоник, а преосталих 6% је маса водоника. Ова масена пропорција биће иста за било који молекул воде.[5]
Хемијска имена као одговор на ограничења хемијских формула
Алкен зван бут-2-ен има два изомера, које хемијска формула не идентификује. Релативни положај две метилне групе мора бити назначен додатним записом који означава да ли су метилне групе на истој страни двоструке везе ( или ) или на супротним странама једна од друге ( или ).[6]
Као што је горе поменуто, да би се представиле пуне структурне формуле многих сложених органских и неорганских једињења, могуће је да је потребна хемијска номенклатура која превазилази расположиве ресурсе који су горе коришћени у једноставним кондензованим формулама. Примери се могу видети у номенклатури органске хемије и номенклатури неорганске хемије 2005. Поред тога, линеарни системи именовања, попут Међународног хемијског идентификатора (), омогућавају рачунару да конструише структурну формулу, а поједностављени систем за линијски унос молекула (SMILES) омогућава унос читљивији човеку. Међутим, сви ови системи номенклатуре превазилазе стандарде хемијских формула, и технички су системи именовања хемикалија, а не системи формула.
Полимери у кондензованом формулама
За полимере у кондензованим хемијским формулама, заграде се постављају око јединице која се понавља. На пример, молекул угљоводоника који је описан као , молекул је са педесет понављајућих јединица. Ако је број понављајућих јединица непознат или променљив, слово се може користити за означавање ове формуле: .
Јони у кондензованим формулама
За јоне, наелектрисање на одређеном атому може се означити натписом са десне стране. На пример, + или 2+. На овај начин може се приказати и укупан набој на наелектрисаном молекулу или полиатомском јону. На пример: или SO42−. Треба имати на уму да се + и - користе уместо +1 и -1.
За сложеније јоне, заграде [ ] се често користе за затварање јонске формуле, као у , која се налази у једињењима као што је ]. Заграде ( ) се могу угнездити у заграде да означе понављајућу јединицу, као у . Овде, указује да јон садржи шест група везаних за кобалт и [ ] обухвата целу формулу јона са наелектрисањем +3.
Ово је строго опционо; хемијска формула је важећа са или без информација о јонизацији, а хексаминкобалт() хлорид се може записати као или . Угаоне заграде се, попут заграда, понашају у хемији као у математици, групишући појмове - оне нису посебно примењени само за стања јонизације. У овом последњем случају, заграде указују на 6 група свих истог облика, везаних за другу групу величине 1 (атом кобалта), а затим је цео сноп, као група, везан за 3 атома хлора. У првом случају је јасније да је веза која повезује атоме хлоре јонска, а не ковалентна.
Remove ads
Види још
Референце
Литература
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads