ஐதரசன் சல்பைடு
From Wikipedia, the free encyclopedia
Remove ads
ஐதரசன் சல்பைடு (Hydrogen sulfide, அல்லது hydrogen sulphide, ஹைட்ரஜன் சல்பைட்) என்பது H
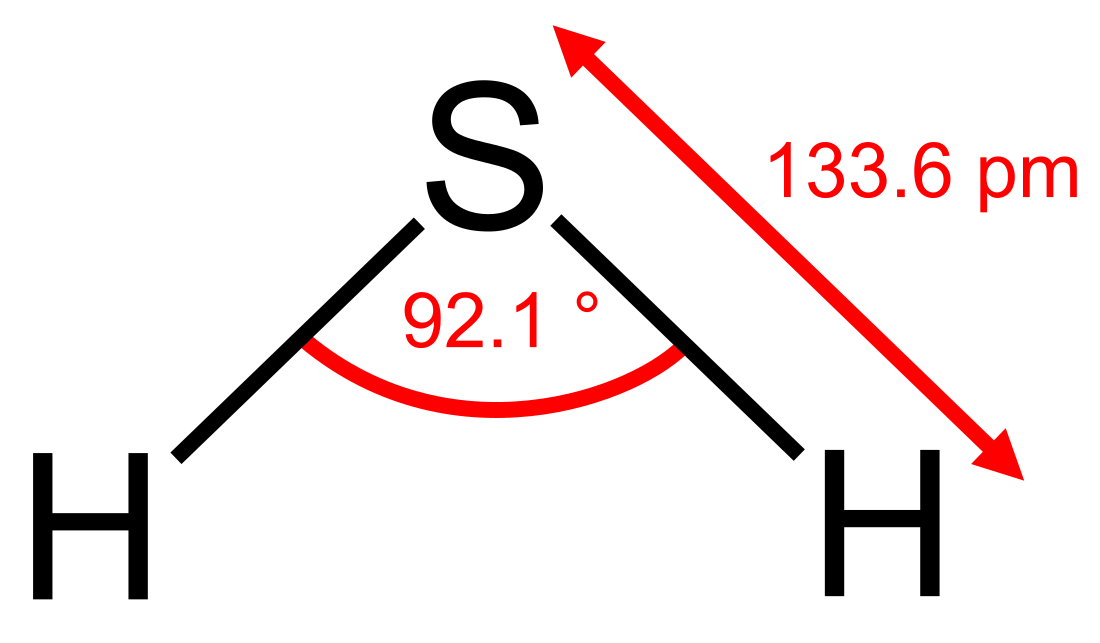
2S என்ற மூலக்கூற்று வாய்ப்பாட்டைக் கொண்ட ஒரு வேதியியல் சேர்மம் ஆகும். இது சாதாரண வெப்பநிலையிலும், அமுக்கத்திலும் அழுகிய முட்டையின் வாடையுடைய ஒரு நிறமற்ற வளிமம் ஆகக் காணப்படும்.
இது வளியை விட அடர்த்தி கூடியது; நச்சுத்தன்மையுடையது; தீப்பற்றக்கூடியது; வெட்டிக்கக்கூடியதுமாகும். இது விலங்குகளுக்கு நஞ்சு என்றாலும், சில வகை பக்டீரியாக்கள் இதனைப் பொறுத்துக்கொள்ளக்கூடிய ஆற்றலுடையவையாகும். இவ்வாறன பக்டீரியாக்கள் ஒக்சிசன் அற்ற சூழ்நிலையில் சேதனப் பொருட்களைப் பிரிகையடையச் செய்து இவ்வாயுவை வெளியிடுகின்றன (சில புரதங்களில் கந்தகம் காணப்படுவதால்). எரிமலைகள் உமிழும் வாயுவிலும், சில கிணறுகளிலும், இயற்கை வாயுவிலும் இவ்வாயு காணப்படுகின்றது. மிகச் சொற்பச் செறிவில் இவ்வாயு ஆபத்தானதல்ல. மனித உடலிலேயே சிறிதளவுக்கு நரம்புக் கணத்தாக்கக் கடத்தலின் போது இது உற்பத்தி செய்யப்படுகின்றது. நீரில் கரையும் போது ஐதரோசல்பூரிக் அமிலம் எனும் மென்னமிலத்தைத் தோற்றுவிக்கின்றது.
Remove ads
பண்புகள்
இயற்பியல் பண்புகள்
- வளியை விட அடர்த்தி கூடியது
- நிறமற்ற வாயு
- விரும்பத்தகாத மணமுடையது
- நீரில் சிறிதளவு கரையக்கூடியது
வேதியியல் பண்புகள்
ஐதரசன் சல்பைடு வாயு வளியில் நீல நிறச் சுவாலையுடன் எரிந்து நீர் மற்றும் கந்தகவீரொக்சைட்டு ஆகியவற்றைத் தோற்றுவிக்கும். உயர் வெப்பநிலையிலும், ஊக்கிகளின் விளைவாலும் ஐதரசன் சல்பைடை கந்தகமாகவும், நீராகவும் மாற்ற முடியும். இம்முறையி கந்தகத்தை உற்பத்தி செய்தல் குளோஸ் முறை எனப்படும்.
இவ்வாயு நீரில் கரைந்து ஐதரோசல்பூரிக் அமிலத்தை உருவாக்குகின்றது. சாதாரண சூழ்நிலையில் இவ்வமிலம் நிலைத்திருக்காது. நீரில் கரைந்துள்ள ஒக்சிசன் வாயுவோடு தாக்கமடைந்து நீரில் கரையாத கந்தகத்தை உருவாக்கலே இதற்குக் காரணமாகும். இதனால் சிறிது நேரத்தின் பின் இவ்வமிலக் கரைசல் மஞ்சள் நிறக் கலங்கலாக மாறுகின்றது. ஐதரசன் சல்பைடு உலோக அயன்களுடன் தாக்கமடைந்த அவ்வுலோக சல்பைடைத் தரும்.
Remove ads
உற்பத்தி
இயற்கை வாயுவில் ஐதரசன் சல்பைடு அதிக செறிவில் காணப்படலாம். இயற்கை வாயுவைத் தூய்மையாக்கும் போது ஐதரசன் சல்பைடு கழிவுப் பொருளாகப் பிரித்தெடுக்கப்படுகின்றது.
ஆய்வு கூடங்களில் கற்றலுக்காக இரு முறைகளில் இவ்வாயுவை உருவாக்கலாம். ஒரு முறையில் இரும்பு சல்பைடுடன் ஒரு வன்னமிலம் தாக்கத்துக்கு உட்படுத்தப்பட்டு இவ்வாயு உருவாக்கப்படுகின்றது.
- FeS + 2 HCl → FeCl2 + H2S
மற்றைய முறையில் அலுமினியம் சல்பைடு நீருடன் தாக்கத்துக்கு உட்படுத்தப்படும்.
- 6 H2O + Al2S3 → 3 H2S + 2 Al(OH)3
Remove ads
கிடைப்பனவு
இவ்வாயு இயற்கையாக பெற்றோலியத்திலும், இயற்கை வாயுவிலும், எரிமலை வாயுக்களிலும் காணப்படுகின்றது. இயற்கை வாயுவில் 90% வரை காணப்படலாம். கிணறுகளில் சல்பேட்டு-தாழ்த்தும் பக்டீரியாக்களின் அனுசேபம் காரணமாக இவ்வாயு/ அமிலக் கரைசல் காணப்படலாம்.
எரிபொருட்களிலிருந்து அகற்றல்
இவ்வாயு இயற்கை வாயு, உயிர் வாயு மற்றும் சாதாரணமாக சமையலில் பயன்படுத்தப்படும் எல்-பி வாயு ஆகியவற்றில் உள்ளது. ஐதரசன் சல்பைடு எரிந்தால் அமில மழைக்குக் காரணமான கந்தகவீரொக்சைட்டைக் கொடுக்கும். எனவே பயன்பாட்டுக்கு விடப்படும் முன் இவ்வாயுக்கள் சுத்திகரிக்கப்படுகின்றன. இதனை பல்வேறு வழிகளில் மேற்கொள்ளலாம். நீரேற்றப்பட்ட இரும்பு(III)ஒக்சைட்டைப் பயன்படுத்தி எரிபொருளாகப் பயன்படும் வாயுக்களிலிருந்து ஐதரசன் சல்பைடைப் பிரித்தெடுக்கலாம்.
- Fe
2O
3(s) + H
2O(l) + 3 H
2S(g) → Fe
2S
3(s) + 4 H
2O(l)
இவ்வாறான சுத்திகரிப்பான்கள் உருளைகளாக இருக்கும். சிறிது காலத்தின் பின் அவற்றிலுள்ள இரும்பு ஒக்சைட்டு முடிவடைந்து விடுவதால், இவற்றின் வினைத்திறன் குறைவடையும். எனினும் இவ்வுருளைகளை நீரில் கழுவி காற்றோட்டம் அளிப்பதால் இவற்றை மீண்டும் இரும்பு ஒக்சைட்டாக மாற்றலாம்.
- 2 Fe
2S
3(s) + 3 O
2(g) + 2 H
2O(l) → 2 Fe
2O
3(s) + 2 H
2O(l) + 6 S(s)
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads