அம்மோனியம் இரும்பு(II) சல்பேட்டு
பெரஸ் அமோனியம் சல்பேட் From Wikipedia, the free encyclopedia
Remove ads
அம்மோனியம் இரும்பு(II) சல்பேட்டு (Ammonium iron(II) sulfate or Mohr's salt), (NH4)2Fe(SO4)2·6H2O என்ற மூலக்கூற்று வாய்ப்பாட்டை உடைய ஒரு கனிமச் சேர்மம் ஆகும். இச்சேர்மமானது, Fe2+ மற்றும் NH4+ என்ற இரண்டு நேர்மின் அயனிகளைக் கொண்டுள்ளது. இச்சேர்மம், அன்னபேதி (அல்லது) பெர்ரசு சல்பேட்டு மற்றும் அம்மோனியம் சல்பேட்டு ஆகியவை கலந்த இரட்டை உப்பாக வகைப்படுத்தப்படுகிறது. இது ஆய்வகத்தில் பயன்படுத்தப்படும் பொதுவான வினைக்காரணியாகும். இதர பெர்ரசு சல்பேட்டு உப்புகளைப் போல பெர்ரசு அம்மோனியம் சல்பேட்டு உப்பும் நீரில் கரைந்து [Fe(H2O)6]2+,என்ற நீருடன் இணைந்த எண்முகி மூலக்கூறு வடிவத்தைக் கொண்ட அணைவுச்சேர்மத்தைத் தருகிறது.
Remove ads
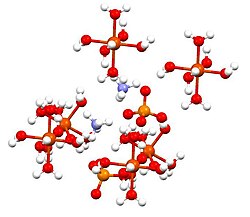
அமைப்பு
இந்தச் சேர்மமானது இசுகோனைட்டுகள் அல்லது டுட்டனின் உப்புகள் என அழைக்கப்படும் இரட்டை உப்புக்களின் குழுவின் அங்கமாக உள்ளது. டுட்டனின் உப்புகள் ஒற்றைச் சாய்வுடைய படிக அமைப்பையும் M2N(SO4)2.6H2O (M = பல்வேறு ஒற்றைநேரயனிகள்) என்ற வாய்ப்பாட்டையும் கொண்ட சேர்மங்களாகும். பிணைப்பு வகையைப் பொறுத்த வரை படிகங்கள் எண்முகி வடிவ [Fe(OH2)6]2+ மையங்களைக் கொண்டுள்ளன. இவை சல்பேட்டு மற்றும் அம்மோனியம் அயனிகளுடன் ஐதரசன் பிணைப்பால் இணைக்கப்பட்டள்ளன.[1]

செருமானிய நாட்டு வேதியியலாளர் கார்ல் பிரெடெரிக் மோர் என்பவரின் பெயரால் இந்த உப்பானது மோரின் உப்பு எனவும் அழைக்கப் படுகிறது. இவர் 19 ஆம் நூற்றாண்டில் தரம்பார்த்தல் சோதனைகளில் பல முன்னேற்றங்களைக் கொண்டு வந்தவராவார்.
Remove ads
பயன்பாடுகள்
பகுப்பாய்வு வேதியியலில் இந்த உப்பானது பெர்ரசு அயனிகளைத் தருவதற்கான தெரிவு செய்யப்பட்ட மூலமாக அமைகிறது. ஏனெனில், இச்சேர்மமானது நீண்ட காலம் சேகரித்து வைக்கப்படுவதற்கான ஆக்சிசனேற்றத்திற்கு எதிரான நிலைப்புத் தன்மையைக் கொண்டுள்ளது. இந்த நிலைப்புத் தன்மையானது, பெர்ரசு/பெர்ரிக் ஆக்சிசனேற்ற ஒடுக்க இரட்டைகளின் மீது pH ன் விளைவை பிரதிபலிக்கும் கரைசல்கள் வரையிலும் விரிவடைகிறது. இத்தகைய ஆக்சிசனேற்றங்கள் அதிக pH மதிப்பு கொண்ட கரைசல்களில் உடனடியாக நிகழ்கிறது. அம்மோனியம் அயனிகள் மோரின் உப்பு அடங்கிய கரைசல்களை சிறிதளவு அமிலத்தன்மை உடையதாக மாற்றி ஆக்சிசனேற்ற வினையின் வேகத்தைக் குறைக்கிறது.[2][3] சல்பூரிக் அமிலமானது பொதுவாக இக்கரைசல்களுடன் பெர்ரசு அயனியானது ஆக்சிசனேற்றம் அடைவைக் குறைக்கும் பொருட்டு சேர்க்கப்படுகிறது.
இச்சேர்மம் ஃப்ரிக்கின் டோசுமீட்டர் என்ற கருவியில் அதிக அளவு காமா கதிர்களின் வீச்சினை அளக்கப் பயன்படுத்தப்படுகிறது.[4]
Remove ads
தயாரிப்பு
மோரின் உப்பானது மோலார் சமான நீரேற்றப்பட்ட பெர்ரசு சல்பேட்டு மற்றும் அம்மோனியம் சல்பேட்டு மற்றும் சிறிதளவு சல்பூரிக் அமிலம் இவற்றின் நீரில் கரைக்கப்பட்ட கலவையிலிருந்து கிடைக்கும் கரைசலைப் படிகமாக்குவதால் தயாரிக்கப்படுகிறது. பெர்ரசு அம்மோனியம் சல்பேட்டானது வெளிர் பச்சை நிறப் படிகங்களாக கிடைக்கிறது.
மாசுகள்
ஆய்வக வேதிப்பொருட்களுக்கான தூய்மைத் தரநிலைகள் நிலையான மோர் உப்புக்கு ≥99% தூய்மையை மட்டுமே குறிப்பிடுகின்றன. தரம்பார்த்தலில் பயன்படுத்தப்படுவதற்கு முன் உப்பானது மறுமுறை படிகமாக்கப்பட்டு, வடிகட்டி, கழுவி உலர வைக்கப்பட வேண்டும். பொதுவான உலோக மாசுகளாக Mg, Mn, Ni, Pb மற்றும் Zn ஆகியவை உள்ளன.[5]
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads