పొటాషియం పర్మాంగనేట్
From Wikipedia, the free encyclopedia
Remove ads
పొటషియం పర్మాంగనేట్ అసేంద్రయ రసాయన పదార్థం. ఒక ఔషథంగా దీనిని గాయాలను, వ్యాధి గ్రస్తమైన చర్మాన్ని శుభ్రం చేయడానికి ఉపయోగిస్తారు. [2] దీని రసాయన ఫార్ములా KMnO4. ఈ లవణంలో K+ , MnO−
4 అయాన్లు ఉంటాయి. ఇది బలమైన ఆక్సీకరణ కారకం. ఇది నీటిలో కరిగి పింక్ లేదా ఊదా రంగు ద్రావణాన్ని ఏర్పరుస్తుంది. [3] 2000లో ప్రపంచవ్యాప్తంగా దీని ఉత్పత్తి 30,000 టన్నులుగా అంచనా వేయబడింది.[4] ఈ సమ్మేళనంలో మాంగనీస్ ఆక్సీకరణ స్థితి +7 ఉంటుంది.
అభివృద్ధి చెందుతున్న ప్రపంచంలో ఈ పదార్థం హోల్సేల్ ధర సుమారు ఒక గ్రాము చూర్ణానికి US$0.01 ఉంటుంది..[5] యునైటెడ్ కింగ్డమ్లో 400 మిల్లీగ్రాముల టాబ్లెట్ విలువ సుమారు £0.51.[2]
Remove ads
ఉపయోగాలు
పొటాషియం పర్మాంగనేట్ అన్ని అనువర్తనాలు ముఖ్యంగా ఆక్సీకరణ ధర్మాలపై ఆధారపడి ఉంటాయి.[4] ఇది బలమైన ఆక్సీకరణిగా విషతుల్యమైన ఉప ఉత్పత్తులను ఏర్పరచదు. ఇది అనేక సముచిత ఉపయోగాలను కలిగి ఉంది.
వైద్య ఉపయోగాలు
పొటాషియం పర్మాంగనేట్ను పాదాలకు గల ఫంగల్ ఇన్ఫెక్షన్లు, తెల్లని బొబ్బలు, చర్మపు శ్లేష్మపోరలో బొబ్బలు, ఉపరితల గాయాలు, ట్రాపికల్ అల్సర్లు వంటి చర్మ రోగాలకు ఉపయోగిస్తారు. [6] [2] ఇది సాధారణ ఆరోగ్య వ్యవస్థ కోసం అవసరమైన మందుల జాబితా యైన "ప్రపంచ ఆరోగ్య సంస్థ ఆవశ్యక మందుల జాబితా"లో స్థానం సంపాదించింది.[7]
నీటి చికిత్స
పొటాషియం పర్మాంగనేటును నీటి శుద్ధి పరిశ్రమలో ఉపయోగిస్తారు. దీనిని పునరుత్పత్తి రసాయనంగా ఇనుము, హైడ్రోజన్ సల్ఫైడ్ (కుళ్లిన కోడిగుడ్ల వాసన గలది) లను "మాంగనీస్ గ్రీన్సేండ్" వడపోత ద్వారా నూతి నీటిని శుద్ధి చేసేందుకు ఉపయోగిస్తారు. స్విమ్మింగ్ పూల్ కు అవసరమైన రసాయనాల పదార్థాలు అమ్మే స్టోర్స్ లలో దీనిని "పాట్-పెర్మ్" అనే పేరుతో పొందవచ్చును. ఈ పదార్థం అదనంగా వ్యర్థ నీటిని చికిత్స చేయుటకు ఉపయోగపడుతుంది. చారిత్రికంగా త్రాగునీటికి రోగకారక జీవులు చేరకుండా శుభ్రపరుచుటకు ఉపయోగిస్తూన్నారు.[8][9] ఇది నీటిని పింక్ రంగులోనికి మార్చుతుంది.[10] ఇది ప్రస్తుతం తాజా నీటి సేకరణ, చికిత్స వ్యవస్థల్లో "జీబ్రా మస్సెల్స్" వంటి విలక్షణ జీవుల నియంత్రణ ఉపయోగిస్తున్నారు.[11]
సేంద్రియ సమ్మేళనల సంశ్లేషణలో
ఈ పదార్థాన్ని నీటి శుద్ధి కార్యక్రమాలలో వాడటమే కాకుండా సేంద్రియ సమ్మేళనాల సంశ్లేషణలో కారకంగా ఉపయోగిస్తారు.[12] అవసరమైన మొత్తంలో పొటాషియం పర్మాంగనేటు ఆస్కార్బిక్ ఆమ్లం, క్లోరంఫెనికాల్, సచ్ఛరిన్, ఐసోనికోటినిక్ ఆమ్లం, పైరాజినోయిక్ ఆమ్లం వంటి పదార్థాల సంశ్లేషణలో ఉపయోగిస్తారు.[4]
జర్మన్ కర్బన రసాయన శాస్త్రవేత్త "అడోల్ఫ్ వాన్ బేయర్" పేరుతో "బేయన్ కారకం" అనే పేరుతో పిలుస్తారు. KMnO4 ను పరిమాణాత్మక సేంద్రియ విశ్లేషణా పరీక్షలలో ఉపయోగిస్తారు. ఈ కారకం పొటాషియం పర్మాంగనేటు క్షారయుత ద్రావణం. ద్వి లేదా త్రిబంధాలతో చర్యలు (-C=C- or -C≡C-) పర్పల్ పింక్ రంగులో నుండి ఊదా రంగులోనికి మారుస్తాయి. ఆల్డిహైడ్లు, ఫార్మిక్ ఆమ్లం కూడా ధనాత్మక ఫలితాలనిస్తాయి.[13] ఈ పరీక్ష పురాతనమైనది.

పండ్ల సంరక్షణ
ఇధిలీన్ శోషకాలు అధిక ఉష్ణోగ్రతల వద్ద కూడా అరటి పండ్లను నిల్వ సమయాన్ని ఎక్కువ చేస్తాయి. పొటాషియం పర్మాంగనేటుతో కలసి పాలిథీన్ సంచులలో అరటిపండ్లను పాకింగ్ చేయడం వలన ఈ సమయాన్ని తగ్గించవచ్చును. ఆక్సీకరణం ద్వారా ఇధిలీన్ ను తొలగించడం ద్వారా కాయలు పండ్లుగా నెమ్మదిగా మారుతాయి. ఈ విధంగా చేయడం వలన పండు జీవిత కాలాన్ని 4 వారాల వరకు ఏ ఫ్రిజ్ లో ఉంచకుండానే నిల్వ చేయవచ్చును.[14][15][16]
అగ్నిమాపక సేవలు
పొటాషియం పర్మాంగనేటు "ప్లాస్టిక్ స్ఫియర్ దిస్పెన్సరీస్"లో ఉపయోగించి మంటలను జ్వలింపజేయవచ్చు. పాలీమర్ గోళాలు పింగ్-పాంగ్ బంతులుగా మార్చి అందులో కొద్ది పరిమాణంలో పర్మాంగనేటును ఉంచుతారు. ఆ బంతులలోనికి ఇధిలీన్ గ్లైకాల్ ను ఇంజక్షన్ చేసి మంటలు కావలసిన చోట ఆ బంతులను వదులుతారు. కొన్ని సెకండ్ల వ్యవధిలో మంటలు ఏర్పడతాయి.[17][18]
Remove ads
చరిత్ర
1659లో జోహన్ రుడాల్ఫ్ గ్లాబర్ పైరోలుసైట్ (మాంగనీస్ డైఆక్సైడ్, MnO2) ఖనిజం, పొటాషియం కార్బొనేట్ లను సంలీనం చేసి నీటిలో కరిగే ఉత్పన్నాన్ని తయారు చేసాడు. ఈ ఉత్పన్నం నీటిలో కలసి ఆకుపచ్చని ద్రావణాన్ని (పొటాషియం మాంగనేట్) ను ఏర్పరుస్తుంది. తరువాత ఆ ద్రావణం నెమ్మదిగా వయొలెట్ రంగులోకి మారి చివరికి ఎరుపు రంగులోనికి మారింది.[19] ఈ నివేదిక మొదటి సారి పొటాషియం పర్మాంగనేట్ ఉత్పత్తికి మొదటి వివరణ అయింది.[20] 200 సంవత్సరాల తరువాత, క్రిమిసంహారకాలపై ఆసక్తి ఉన్న లండన్ రసాయన శాస్త్రవేత్త హెన్రీ బోల్ల్మన్న్కాండీ, పైరోలుసైట్ ను సోడియం హైడ్రాక్సైడ్ (NaOH) తో సంలీనం చేసి నీటిలో కరిగించాడు. ఏర్పడిన ద్రావణం క్రిమిసంహారక లక్షణాలు కలిగి ఉంది. ఈ ద్రావణానికి పేటెంట్ హక్కులు పొంది "కాండీ ఫ్లూయిడ్" పేరుతో మార్కెట్ లోనికి విడుదల చేసాడు. ఈ ద్రావణం ప్రభావవంతమైనదైనప్పటికీ స్థిరమైనది కాదు. దీనిని అధిగమించడానికి సోడియం హైడ్రాక్సైడ్ కు బదులుగా పొటాషియం హైడ్రాక్సైడ్ ను వాడారు. అపుడు స్థిరమైన ద్రావణం ఏర్పడినది. దీనిని సులువుగా పొటాషియం పర్మాంగనేటు స్ఫటికాలుగా మార్చవచ్చు. ఈ స్ఫటికీకృత పదార్థాన్ని "కాండీస్ క్రిస్టల్స్" లేదా "కాండీస్ పౌడర్" అని పిలిచేవారు.
Remove ads
తయారీ
పొటాషియం పర్మాంగనేట్ పారిశ్రామికంగా మాంగనీస్ డైఆక్సైడ్ నుండి తయారుచేస్తారు. మాంగనీస్ డైఆక్సైడ్ ఖనిజం పైరోలుసైట్. మాంగనీస్ డైఆక్సైడ్ను పొటాషియం హైడ్రాక్సైడ్ తో సంలీనం చెందించి గాలిలో లేదా వేరొక ఆక్సిజన్ వనరు (పొటాషియం నైట్రేట్ లేదా పొటాషియం క్లోరేట్) లో వేడిచేసినపుడు పొటాషియం మాంగనేట్ ఏర్పడుతుంది.[4] :
- 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
(సోడియం హైడ్రాక్సైడ్ తో చివరి ఉత్పన్నం సోడియం మాంగనేట్ కాదు కానీ ఒక Mn(V) సమ్మేళనం. పొటాషియంపర్మాంగనేటును సోడియం పర్మాగనేటు కన్నా ఎక్కువగా వాడటానికి ఇదే కారణం. తరువాత పొటాషియం లవణం స్ఫటికీకరణం చెందుతుంది.[4])
అపుడు పొటాషియం మాంగనేట్ క్షారయుత మాధ్యమంలో విద్యుత్ ఆక్సీకరణం చెంది పర్మాంగనేటుగా మారుతుంది.:
- 2 K2MnO4 + 2 H2O → 2 KMnO4 + 2 KOH + H2
ఇతర పద్ధతులు
వాణిజ్యపరమైన ప్రాముఖ్యత లేనప్పటికీ, పొటాషియం మాంగనేట్, క్లోరిన్ ద్వారా ఆక్సీకరణం చెందుతుంది.[21] క్లోరిన్ ఆక్సీకరణ చర్య ఈ క్రింది విధంగా ఉంటుంది.
- 2 K2MnO4 + Cl2 → 2 KMnO4 + 2 KCl
ఆమ్ల ప్రేరిత డిస్ప్రొపోర్షినేషన్ చర్యలు ఈ క్రింది విధంగా రాయవచ్చు.
- 3 K2MnO4 + 4 HCl → 2 KMnO4 + MnO2 + 2 H2O + 4 KCl
కార్బానిక్ ఆమ్లం లాంటి బలహీన ఆమ్లం ఈ చర్యకు సరిపడినంతగా ఉంటుంది.
- 3 K2MnO4 + 2 CO2 → 2 KMnO4 + 2 K2CO3 + MnO2
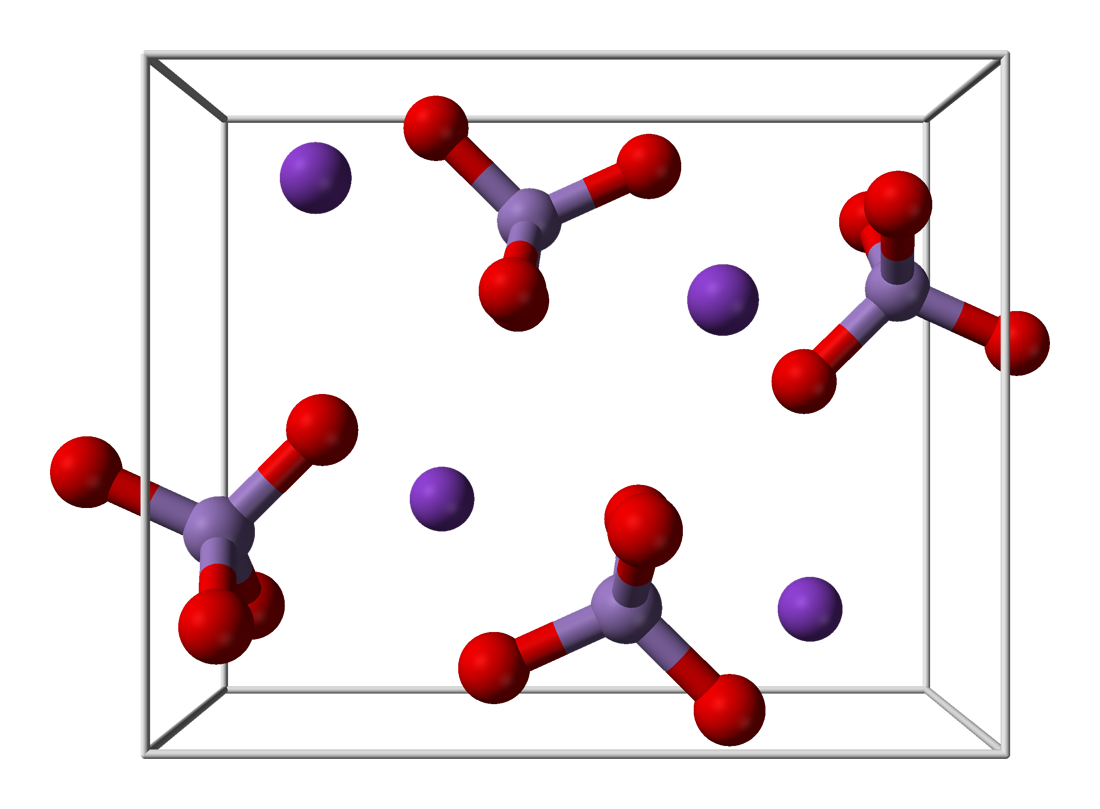
నిర్మాణం
KMnO4 ఆర్థోరాంబిక్ స్పటికాలను ఏర్పరుస్తుంది. మొత్తం మూలాంశం బేరియం సల్ఫేట్ ను పోలి ఉండి ఘన ద్రావణాలను ఏర్పరచగలదు. [22] ఘన ద్రావణాలలో ప్రతీ MnO4− కేంద్రములు టెట్రాహైడ్రల్ ఆకృతి కలిగి ఉంటాయి. Mn–O మధ్య బంధ దైర్ఘ్యం 1.62 Å.[23] ఉంటుంది.
చర్యలు
కర్బన సమ్మేళనాల రసాయన శాస్త్రం
KMnO4 సజల ద్రావణాలు క్షార ద్రావణాలను డైఓల్స్ (గ్లైకోల్స్) గా మారుస్తాయి. ఈ ప్రవర్తన ఒక అణువులోని ద్వి లేద త్రిక బంధాల ఉనికి కొరకు చేసే గుణాత్మక పరీక్షకు ఉపయోగపడుతుంది. ఈ చర్యలో పర్పల్ రంగు గల పర్మాంగనేట్ ద్రావణం ఊదా రంగు అవక్షేపంగా మారుతుంది. ఈ సందర్భంగ్లో దీనిని "బేయర్స్ కారకం" అని పిలుస్తారు.
ఆమ్ల పరిస్థితులలో, క్షారయుత ద్విబంధం విచ్ఛిన్నం జరిగి తగిన కార్బాక్సిలిక్ ఆమ్లాన్ని ఇస్తుంది::[24] CH3(CH2)17CH=CH2 + 2 KMnO4 + 3 H2SO4 → CH3(CH2)17COOH + CO2 + 4 H2O + K2SO4 + 2 MnSO4
పొటాషియం పర్మాంగనేటి ఆల్డిహైడ్లను ఆక్సీకరణం చెందించి కార్బోక్సిలిక్ ఆమ్లంగా మారుస్తుంది. ఇందులో n-హెప్టనాల్ నుండి హెప్టానోయిక్ ఆమ్లంగా మారుతుంది.::[25] 5 C6H13CHO + 2 KMnO4 + 3 H2SO4 → 5 C6H13COOH + 3 H2O + K2SO4 + 2 MnSO4
ఆరోమాటిక్ వలయంపై గల ఏదైనా అల్కైల్ గ్రూపు ఆక్సీకరనం చెందుతుంది. ఉదా: టోలీన్ నుండి బెంజనోయిక్ ఆమ్లం ఏర్పడుట.[26]
- 5 C6H5CH3 + 6 KMnO4 + 9 H2SO4 → 5 C6H5COOH + 14 H2O + 3 K2SO4 + 6 MnSO4
గ్లైకాల్స్, పోలీయాల్స్ KMnO4తో అత్యధిక చర్యాశీలతను కల్గి ఉంటాయి. ఉదాహరణకు, చక్కెర జల ద్రావణం, సోడియం హైడ్రాక్సైడ్ లకు పొటాషియంపర్మాంగనేటును కలిపితే కెమికల్ ఛామెలియన్ (రిడాక్స్ చర్య) జరుగుతుంది. ఇది మాంగనీస్ వివిధ ఆక్సీకరణ స్థితులకు సంబంధించిన నాటకీయ రంగు మార్పులను కలిగి ఉంటుంది.
పొటాషియం పర్మాంగనేట్, గ్లిజరాల్ లేదా పల్వరీకరణం చేయబడిన గ్లూకోజ్ ల మిశ్రమం తక్షణమే మండే గుణం కలిగి ఉంటుంది. [27]
ఆమ్లాలతో చర్య
గాఢ సల్ఫ్యూరిక్ ఆమ్లంతో KMnO4 చర్య పొంది Mn2O7 ఏర్పడుతుంది. ఇది ప్రేలుడు పదార్థం.[28] పొటాషియం పర్మాంగనేట్ గాఢ హైడ్రోక్లోరిక్ ఆమ్లంతో చర్యపొంది క్లోరిన్ను ఇస్తుంది. ఆక్సీకరణ-క్షయకరణ చర్యలు (రిడాక్స్ రియాక్షన్స్) నుండి ఏర్పడిన మాంగనీస్ తో కూడిన ఉత్పత్తులు దాని PH పై ఆధారపడి ఉంటాయి. పర్మాంగనేటు ఆమ్ల ద్రావణాలు క్షయకరణం చెంది పింక్ రంగుతో కూడిన మాంగనీస్ (II) అయాన్ (Mn2+) , నీటిని ఏర్పరుస్తుంది. తటస్థ ద్రావణాలలో పర్మాంగనేట్ మాత్రమే మూడు ఎలక్ట్రాన్లతో క్షయకరణం చెంది మాంగనీస్ డై ఆక్సైడ్ (MnO2) ఏర్పడుతుంది. ఇందులో మాంగనీస్ ఆక్సికరణ స్థితి +4. ఈ పదార్థం KMnO4ను తాకినపుడు చర్మంపై మరకలను ఏర్పరుస్తుంది. KMnO4 ఆకశ్మికంగా క్షారయుత ద్రావణాలలో క్షయకరణం చెంది ఆకుపచ్చని K2MnO4 పదార్థం ఏర్పరుస్తుంది. ఇందులో మాంగనీస్ ఆక్సీకరణ స్థితి +6.
గాఢ సల్ఫ్యూరికామ్లంతో పొటాషియం పర్మాంగనేటు కలిసినపుడు ఒక ఆసక్తి కరమైన చర్య జరుగుతుంది. చూడటానికి ఏ విధమైన ప్రతిస్పందనలు లేనప్పటికీ మిశ్రమం మీద ఏర్పడిన బాష్పాలు ఆల్కహాల్ తో తడిపిన కాగితాన్ని మండిస్తాయి. పొటాషియం పర్మాంగనేటు, సల్ఫ్యూరికామ్లం చర్య జరిగి కొంత ఓజోన్ను ఉత్పత్తి అవుతుంది.[29][30]
ఉష్ణ వియోగ చర్య
ఘన స్థితిలో ఉన్న పొటాషియం పర్మాంగనేట్ వేడిచేసినపుడు వియోగం చెందుతుంది:
- 2KMnO4 → K2MnO4 + MnO2(s) + O2
ఇచట, మాంగనీస్ ఆక్సీకరణ స్థితి పొటాషియం పర్మాంగనేట్ (ఆక్సీకరణ స్థితి +7)గా మారి వియోగం చెంది పొటాషియం మాంగనేట్ (ఆక్సీకరణ స్థితి +6) , మాంగనీస్ డై ఆక్సైడ్ (ఆక్సీకరణ స్థితి +4) గా ఏర్పరుస్తుంది. ఆక్సిజన్ వాయువు విడుదలవుతుంది.
Remove ads
భద్రత
పొటాషియం పర్మాంగనేటు ఒక ఆక్సీకరణిగానష్ఠం కలిగిస్తుంది.[31]
చర్మంపై ఎక్కువసేపు తగిలి ఉండేటట్లు చేస్తే పింగ్/ఊదా రంగు మచ్చలు ఏర్పడతాయి.[32]
మూలాలు
బయటి లింకులు
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads