Топ питань
Часова шкала
Чат
Перспективи
Електронна конфігурація
З Вікіпедії, вільної енциклопедії
Remove ads
Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента.

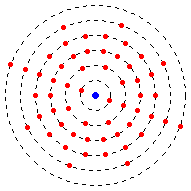
З погляду квантової механіки, електронна конфігурація — це повний перелік одноелектронних хвильових функцій, із яких з достатнім рівнем точності можна скласти повну хвильову функцію атома (у наближенні самоузгодженого поля).
Електронна конфігурація атома значною мірою визначає його хімічні властивості.
Розрізняють:
- Для молекулярної частинки — розподіл електронів, згідно з принципом Паулі, між одноелектронними хвильовими функціями (молекулярними орбіталями). Хвильова функція для даної електронної конфігурації, що є власною функцією спінових операторів S2 та Sz представляє електронний стан молекули. При цьому можуть виникнути декілька електронних станів із різними мультиплетностями, наприклад, для молекули кисню характерними є синглетний та триплетний стани.
- Для атома — стан, що відповідає певному заселенню атомних орбіталей атома згідно з принципом побудови, правилом Гунда та принципом Паулі. Записується як послідовність чисел електронів на кожній орбіталі або підоболонці атома. Є декілька способів такого запису. Звичайно запис підоболонок (англ. subshell notation) реєструє підоболонки в порядку збільшення енергії та числа електронів у кожній підоболонці, що зазначається суперскриптом.
Remove ads
Нотація
Для позначення електронної конфігурації хімічного елементу використовують назви орбіталей: s, p, d, f, g. Перед назвою орбіталі стоїть основне квантове число, а верхній індекс після позначення орбіталі вказує на те, скільки електронів є на орбіталях даного сорту.
Наприклад, для неону електронна конфігурація записується 1s22s22p6. Цей запис означає, що неон має два електрони на внутрішній s-орбіталі, 2 електрони на зовнішній s-орбіталі й 6 електронів на зовнішній p-орбіталі.
Для заліза електронну конфігурацію можна записати таким чином [Ar]3d64s2. Це означає, що внутрішні оболонки заліза заповнені так само, як у аргону, а решту 8 електронів розподілені так: d-оболонка заповнена не повністю, два електрони перебувають на зовнішній 4s-оболонці. На d-оболонці — 6 електронів (із можливих 10).
Remove ads
Розподіл електронів в атомі
Узагальнити
Перспектива
Заповнення електронами атомних орбіталей підкоряється певним правилам:
- Правило Паулі (заборона Паулі). В атомі не може бути двох електронів з тотожними значеннями всіх чотирьох квантових чисел.
- Правило Хунда. При заповненні електронних підрівнів сумарне спінове число повинне бути максимальним. Тобто не може бути одночасно незаповненою хоча б одна комірка в підрівнях і два електрони в одній з них.
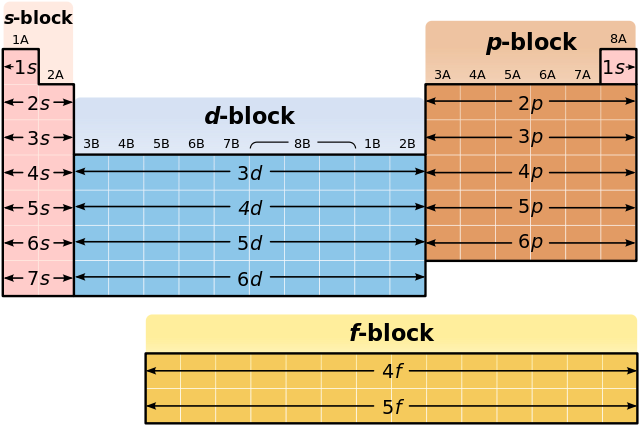
- Принцип Ауфбау. Базис періодичної системи хімічних елементів, який полягає в тому, що в основному стані атома, або іона, електрон спочатку займає енергетичний рівень з найменшою доступною енергією[1], яка визначається повним квантовим числом , де — головне квантове число, яке визначає період, — азимутальне квантове число, яке визначає блок (s, p, d, f block) в структурі періодичної системи[2].
Remove ads
Див. також
Примітки
Посилання
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



