Топ питань
Часова шкала
Чат
Перспективи
Тіосульфат натрію
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
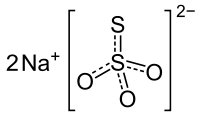
Ті́осульфа́т на́трію — неорганічна сполука, натрієва сіль тіосульфатної кислоти складу Na2S2O3. За звичайних умов перебуває у формі свого кристалогідрату Na2S2O3·5H2O, який є безбарвними кристалами; при невеликому нагріванні втрачає кристалізаційну воду. Тіосульфат проявляє сильні відновні властивості, здатен утворювати координаційні сполуки із металами.
Напівлетальна доза тіосульфату натрію складає 7,5±0,752 г/кг тіла (для мишей).[3] Завдяки своїй низькій токсичності, тіосульфат може вільно використовуватися у медичніх цілях — він є антидотом при отруєннях ціанідами і сполуками срібла.
Тіосульфат натрію застосовується у фотографії для розчинення броміду срібла, у целюлозно-паперовій і текстильній галузях — для нейтралізації залишків хлору. Тіосульфат є реагентом для визначення вмісту йоду, брому, хлору та сірки за методом йодометрії. В харчовій промисловості тіосульфат натрію застосовується як антиоксидант та секвестрант; у міжнародному реєстрі харчових добавок він має код E539.[4]
Remove ads
Фізичні властивості
Чистий тіосульфат натрію є білим, важким порошком, проте за звичайних умов він перебуває у формі свого пентагідрату Na2S2O3·5H2O, який кристалізується з розчинів у вигляді коротких призматичних або довгастих кристалів. На сухому повітрі, при 33 °C, він втрачає вологу, а при 48 °C тіосульфат розчиняється у власній кристалізаційній воді.
Remove ads
Отримання
Узагальнити
Перспектива
У промисловості тіосульфат натрію синтезують окисненням сульфіду, гідросульфіду або полісульфідів натрію. Окрім того, одним із поширених способів є взаємодія сірки із сульфітом натрію:
Додавання сірки до суспензії сульфіту проводять при постійному перемішуванні. Внесення катіонних поверхнево-активних речовин збільшує змочування сірки і, відповідно, швидкість реакції. Вихід реакції залежить від температури, кількості сірки та інтенсивності перемішування. Розчини тіосульфату натрію фільтрують гарячими, попередньо позбувшись надлишку сірки, і при охолодженні з них кристалізується гідрат Na2S2O3·5H2O, який дегідратують при температурі 60—105 °C за атмосферного або зниженого тиску. Чистота продукту складає близько 99% та має незначні домішки сульфіту і сульфату натрію.
Іншими промисловими способами є обробка сполук натрію діоксидом сірки:
Тіосульфат натрію також синтезується як побічний продукт у виробництві сірчаних барвників, де полісульфіди натрію окиснюються нітросполуками:
Remove ads
Хімічні властивості
Узагальнити
Перспектива
Перебуваючи за звичайних умов у формі кристалогідрату, тіосульфат втрачає воду при слабкому нагріванні:
Подальше нагрівання спричиняє розкладання речовини: із утворенням сірки або пентасульфіду натрію (із домішками інших полісульфідів):
У затемненому місці розчин тіосульфату може зберігатися протягом кількох місяців, але при кип'ятінні він одразу розкладається.
Тіосульфат є нестійким до дії кислот:
Він є сильним відновником:
При взаємодії із галогенами тіосульфат відновлює їх до галогенідів:
Остання реакція знайшла застосування в аналітичній хімії у титриметричному методі йодометрія.
Тіосульфат бере участь у реакціях комплексоутворення, зв'язуючи сполуки деяких металів, наприклад, срібла:
Remove ads
Застосування
Тіосульфат натрію широко застосовується у фотографічній справі для розчинення броміду срібла з негативів чи відбитків. У целюлозно-паперовій і текстильній галузях тіосульфат застосовується для нейтралізації залишків хлору; він бере участь у дехлоруванні води.
У гірництві Na2S2O3 виконує роль екстрагента срібла з його руд. Тіосульфат є реагентом для визначення вмісту йоду, брому, хлору та сірки за методом йодометрії. Також тіосульфат є антидотом при отруєннях ціанідами і сполуками срібла.
Remove ads
Див. також
Вікісховище має мультимедійні дані за темою: Тіосульфат натрію
Примітки
Джерела
Посилання
Structure
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


















![{\displaystyle \mathrm {2Na_{2}S_{2}O_{3(conc.)}+AgCl\longrightarrow Na_{3}[Ag(S_{2}O_{3})_{2}]+NaCl} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/8631851f2892dc0dfcfe005e997cf2113b691aa4)