热门问题
时间线
聊天
视角
气性坏疽
来自维基百科,自由的百科全书
Remove ads
气性坏疽(Gas gangrene),亦称为肌肉坏死(Myonecrosis)或梭菌性肌肉坏死(Clostridial myonecrosis),是一种由梭状芽孢杆菌属引起的深层软组织感染,具有高度致命性。其中,产气荚膜梭菌是最常见的致病菌。[9][5] 这种疾病的特征是受伤组织快速发展成坏疽,并产生恶臭气体。
Remove ads
病原学
梭菌感染通常发生在受创伤的组织中,但也可能自发产生。感染涉及较深的组织,例如肌肉,并可能沿着组织层面迅速扩散,病人往往表现出败血症的症状。感染可能在最初创伤和细菌接种后的数小时至数周内发展。细菌接种并不一定会导致气性坏疽,宿主和病原体的因素共同决定了感染是否会进一步发展。免疫功能低下的病人以及局部组织缺氧(由于创伤或血液供应不良)的病人风险最高。引起这些感染最常见的病原体是产气荚膜梭菌(Clostridium perfringens)、败毒梭菌(Clostridium septicum)和溶组织梭菌(Clostridium histolyticum)。败毒梭菌是与消化道异常(如结肠癌)相关的自发性气性坏疽最常见的原因。产气荚膜梭菌和溶组织梭菌则更常与创伤后感染有关。[10][11]
近年来,文献报道了一种不常见的病原体——索氏梭菌(Clostridium sordellii),在使用口服米非司酮和阴道米索前列醇进行药物人工流产后,引起致命的休克综合症和子宫气性坏疽。索氏梭菌也与注射“黑焦油海洛因”有关的感染个案增加有关。此外,这种病原体引致与分娩相关的深层组织感染,以及妇科手术(包括败血性流产)后的感染也有所增加,这些感染可导致子宫气性坏疽。[10][12][13]
Remove ads
流行病学
在美国,肌肉坏死的发病率每年仅约1000宗。在医疗资源和抗生素较匮乏的发展中国家,发病率可能更高,但具体数字不详。即使有最好的护理,包括早期识别、外科处理、抗生素治疗和高压氧治疗,总体死亡率仍达20%至30%,部分研究显示低至5%至10%;然而,若不治疗,此病的致死率为100%。宿主因素,如免疫功能低下状态、糖尿病以及自发性感染,可能导致更高的死亡率,达67%或以上。若感染涉及腹部软组织或胸壁,死亡率可高达60%,相比之下,四肢感染的死亡率较低,约为5%至30%。[14][15]
病理生理学
产气荚膜梭菌(C. perfringens)导致了80%至90%的气性坏疽病例,但其他梭菌属也可以引起感染。按流行程度排序,它们是:诺维氏梭菌(Clostridium novyi)(40%)、败毒梭菌(C. septicum)(20%)、溶组织梭菌(C. histolyticum)(10%)、双发酵梭菌(Clostridium bifermentans)(10%)、谬误梭菌(Clostridium fallax)(5%)和索氏梭菌(C. sordellii)。这些微生物存在于土壤和有机废物中,特别是受粪便污染的环境。
如果伤口中存在厌氧的革兰氏阳性杆菌,并伴有软组织和肌肉坏死,医护人员应怀疑是气性坏疽。这些微生物会产生气体,可在X光或CT扫描中观察到。只有约5%被梭菌定植的伤口会发展成感染。因此,宿主因素和细菌接种的解剖位置有助于判断细菌是否会发展成梭菌性肌肉坏死感染。例如,深层穿透性肌肉伤口,加上宿主免疫功能低下,比免疫系统健康、营养状况良好的宿主更容易发展成感染。较开放的表层伤口,特别是经过适当清洁和包扎后,相较于深层穿透性伤口或伴有挤压伤和组织缺血的伤口,感染的可能性较小。[16]
梭菌属微生物产生α和θ外毒素,这些毒素会造成广泛的组织损伤。感染可以迅速扩散,在数小时内,病人可能出现严重的休克、败血症甚至死亡。氧气张力较高的组织(70 mmHg)会抑制微生物的生长,因为梭菌属是兼性厌氧菌。兼性厌氧菌是指在有氧气时通过有氧呼吸产生ATP,但在缺氧时可以转换为发酵的微生物。如果组织的氧气张力低于30 mmHg,梭菌属微生物会生长得更快。感染的发展速度可以很慢(数周)或很快(数小时),取决于组织的氧气张力和接种的微生物数量。[17]
微生物的毒力取决于其产生的外毒素;产气荚膜梭菌最具致病性,已知有17种毒素,其中毒性最强的是α-毒素,一种卵磷脂酶。α-毒素是一种磷脂酶(卵磷脂酶),能分解细胞膜,引发血小板聚集、血栓形成和组织胺释放。此外,还存在胶原酶、透明质酸酶、血凝素和溶血素。θ-毒素直接造成血管损伤和白血球分解,导致宿主对感染的炎症反应减弱。胶原酶分解结缔组织,使微生物能够迅速跨越组织层面扩散。这是感染能够穿过结缔组织层面,扩散到更深层肌肉组织的主要原因之一。[12][18][19]
病征与临床表现

(a) 水肿性肠壁的宏观图像,可见多个黏膜下层及浆膜下层囊肿
(b) 肠道黏膜的组织病理学图像,显示非反应性坏死
(c) 囊肿的革兰氏染色,显示大型杆状细菌
(d) 黏膜下囊肿中发现的细菌的电子显微镜图像

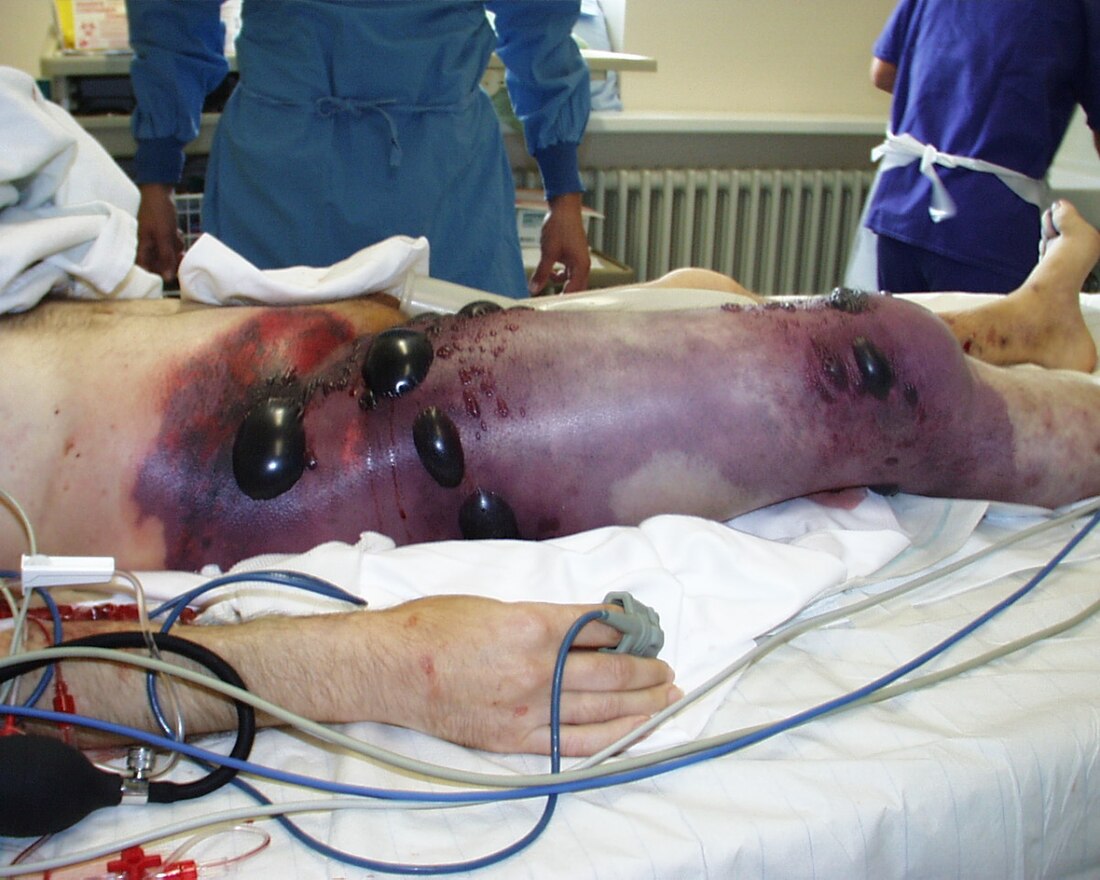
患有气性坏疽(肌肉坏死)的病人会出现感染迹象,如发烧、发冷、疼痛。然而,相较于这些感染的深层穿透性质,感染部位的表层炎症反应可能不如预期般严重。如果不积极治疗,病人的状况可能迅速恶化至败血症甚至死亡。伤口分泌物通常呈“洗碗水”样(dishwater-looking),带有霉味。感染可能波及供应大面积受感染组织的血管,导致皮下脂肪坏死,向下延伸至筋膜并进入更深的肌肉层。如果神经受损,疼痛的严重程度可能低于感染范围所预期的程度。坏死组织的引流物常呈洗碗水样外观,并带有霉味。严重败血症的迹象包括败血性休克、成人呼吸窘迫综合征(ARDS)、弥漫性血管内凝血(DIC)和溶血,后者可能导致溶血性贫血,这也常是病人就诊时的表现。任何患有蜂窝组织炎的病人,如果出现因组织内气体引起的骨擦音,以及皮肤呈坏死或暗紫色外观,都应评估是否患有气性坏疽。[1][2][3]
Remove ads
组织病理学
毒物动力学
产气荚膜梭菌产生的常见毒素:[20]
- α-毒素: 卵磷脂酶(或磷脂酶),分解细胞膜,导致细胞死亡和组织坏死。此毒素也具有溶血性和心脏毒性。
- β-毒素: 引起组织坏死。
- δ-毒素: 溶血素。
- ε-毒素: 增加细胞膜通透性;通透酶。
- ι-毒素: 引起组织坏死。
- κ-毒素: 胶原酶、明胶酶,引起组织坏死。特别破坏血管和结缔组织。
- λ-毒素: 蛋白酶。
- μ-毒素: 透明质酸酶。
- ν-毒素: 脱氧核糖核酸酶,具有溶血性和引起组织坏死。
- φ-毒素: 溶血素、细胞溶解素。
评估
对怀疑患有气性坏疽的病人,应立即进行的检查包括:全血细胞计数、全套代谢检查(CMP)、尿液分析、凝血酶原时间、活化部分凝血活酶时间(APTT)、血液和伤口细菌培养。其他血液测试如动脉血气分析(ABG)、乳酸和降钙素原有助于评估败血症,这在气性坏疽中很常见。常用的影像学检查包括受感染部位的X光、CT扫描和超声波。这些检查有助于确定感染范围、脓疮和组织中的气体。然而,详尽的实验室检查和影像学检查不应延误对坏死组织的决定性外科清创术。在初次外科清创期间,进行深层伤口的需氧和厌氧培养有助于确定致病微生物,并指导抗生素治疗。[6]
治疗与处理
由于气性坏疽感染进展迅速,必须积极治疗病人,措施包括使用抗生素、早期外科会诊及清创、静脉输液复苏、深切治疗部监测,以及辅助性的高压氧治疗(HBOT)。及早进行外科会诊至关重要,因为这是一种真正的外科急症,不应有任何延误。医护人员不应为了等待培养结果而延迟使用抗生素,应立即开始经验性治疗。合理的广谱抗生素覆盖包括万古霉素、他唑巴坦、碳青霉烯类抗生素,或头孢曲松联合甲硝唑。如果怀疑是气性坏疽或坏死性筋膜炎,应加用青霉素加克林霉素,以覆盖A群链球菌引起的坏死性筋膜炎。强烈建议使用克林霉素,因为它能抑制梭菌外毒素的合成,减轻这些毒素的全身性影响。由于克林霉素是抑菌剂而非杀菌剂,应与第二种抗菌药物(如青霉素)联合使用。[21][22][23][8][24]
可能需要进行筋膜切开术以缓解腔室压力。随着感染沿着筋膜下及深层组织扩散,腔室压力会增加,进一步加剧组织缺血和坏死。外科清创应着重于清除所有坏死组织和异物,如泥土、碎屑和弹片。用大量无菌生理盐水冲洗伤口也很重要。在高标准的抗生素和外科清创治疗基础上,应加用高压氧治疗以提高存活率。[24][25] 协调这些危重病人的护理至关重要,需要重症医学科医生、普通外科医生、骨科医生、泌尿科医生(若涉及睾丸和会阴结构的福尼尔氏坏疽)、妇科医生(若涉及子宫气性坏疽)、感染科专科医生、血液学/肿瘤学医生、肠胃科医生(若涉及自发性气性坏疽)以及高压氧治疗专家的共同参与。会诊流程通常由急症室医生开始,并需及早识别疾病。[26][27][26]
早期静脉注射抗生素、早期外科清创,随后进行高压氧治疗,可以挽救患有这种几乎总是致命的疾病的病人。静脉注射抗生素和早期外科清创可将死亡率降至约30%。高压氧治疗可将此数字进一步降至5%至10%。高压氧治疗通过阻止细菌产生外毒素、增强抗生素的杀菌效果、治疗组织缺血、改善组织的再灌注损伤,以及促进干细胞和多形核白血球的活化与迁移来发挥作用。此外,高压氧会诱导血管收缩,减少组织水肿,同时增加氧合作用。组织的氧气张力增加1000倍,这种增加的氧气有助于解决缺氧问题、改善细胞活性、抑制细菌生长,并影响细胞因子的产生,从而增加嗜中性球向受损组织的迁移。高压氧还能增加血管内皮生长因子等生长因子的产生,诱导血管新生和组织修复,促进毛细血管萌芽。这在临床上表现为肉芽组织形成的增加,通常在数次高压氧治疗后可见。[28][29][30][29]
高压氧治疗是将病人置于加压舱内进行,可以是单人舱(mono-place,一次治疗一名病人)或多人舱(multi-place,可同时治疗多名病人)。单人舱一次只能治疗一名病人,医护人员在舱外通过舱门或舱壁上的接口操作专门设备和泵来进行静脉输液甚至机械通气。这种设置的缺点是限制了舱内可进行的治疗。如果病人需要医护人员直接接触,则必须减压并将病人移出舱外。多人舱的优点是可以同时治疗多名病人,且医护人员与病人同在舱内,更方便进行呼吸机支持、静脉治疗、放置胸腔引流管或对气胸进行针刺减压术。治疗气性坏疽的压力为3绝对大气压(ATA)。为降低氧中毒风险,病人每半小时需进行一次“空气间歇”(air break),通常持续5至10分钟。压力下的治疗时间通常约为90分钟,下降(加压)和上升(减压)各需10分钟。[26][31][32][26]
治疗气性坏疽时,最初的5到10次治疗每天进行两次,待病情稳定后减至每天一次。在初步稳定后继续进行高压氧治疗,可以加速组织愈合,为最终的组织移植做准备,这通常是闭合清创术后留下的大面积缺损所必需的。高压氧治疗的风险包括氧中毒(可能引起癫痫发作)、低血糖(尤其是在胰岛素依赖型糖尿病病人中)和气压伤(可能影响耳朵、肺部或任何充满气体的结构,如胃部)以及气体栓塞。这些并发症很少见,除了耳部气压伤,其发生率约为43%(其中84%是轻微的鼓膜充血)。[33]
重要的是,在处理气性坏疽时,必须立即寻求外科会诊,不得延误,因为这是一个紧急情况。应立即开始使用广谱抗生素,无需等待培养结果。合理的覆盖应包括万古霉素、他唑巴坦、碳青霉烯类抗生素,或第三代头孢菌素(如头孢曲松)联合甲硝唑。此外,若怀疑是气性坏疽或坏死性筋膜炎,应加用青霉素加克林霉素以覆盖A群链球菌。强烈建议使用克林霉素。高压氧治疗是气性坏疽的辅助治疗措施之一。然而,高压氧治疗不影响已存在毒素的功能,因此清创术至关重要。血流动力学不稳定的病人可能不适合接受高压氧治疗。此外,动物实验研究未能证明高压氧的治疗效果。[34][25] 一旦通过充分的外科清创控制了持续的组织坏死,应考虑使用负压伤口治疗(Negative pressure wound therapy)。
Remove ads
鉴别诊断
气性坏疽的鉴别诊断包括:[7]
术后及复康护理
气性坏疽病人需要每日或重复进行外科清创,直到坏死性感染得到控制,并接受每日两次的高压氧治疗,直到组织坏死停止并出现肉芽组织形成的恢复迹象。病人还需要持续的深切治疗,可能需要血液透析(若出现肾衰竭)或体外膜氧合(若出现严重成人呼吸窘迫综合征)。感染消退后,许多病人需要进一步的伤口护理,通常包括负压伤口治疗、先进的组织再生技术以及整形外科手术(如植皮和皮瓣手术)来闭合手术伤口。许多气性坏疽病人需要长时间入住深切治疗部,随后进行长期康复以提高生存率和恢复功能。许多病人需要转移到长期护理机构,接受持续的伤口护理、有时是高压氧治疗,以及包括物理治疗和职业治疗的康复计划。[35][36]
为了提高气性坏疽病人的生存率并减少发病率,如果病人出现感染迹象,伴有组织坏死、败血症,或组织中存在气体,应高度怀疑此诊断。早期诊断、立即会诊外科进行紧急清创,并将病人转移到有能力护理此类危重病人的设施至关重要。这些病人需要外科、深切治疗部和高压氧/伤口护理团队之间的协调护理。[37][38]
最佳的治疗效果来自于多个专科之间的协调护理,以及在具备护理危重病人能力的设施中进行深切治疗。护理工作必须在执行清创的外科医生、伤口护理/高压氧治疗提供者和深切治疗部医生之间进行协调。在电子健康纪录中使用照片记录有助于改善护理协调。外科团队可以在手术室拍照,伤口护理团队也可以在更换敷料时拍照。这有助于护士和其他专科(如整形外科和感染科)了解病情进展,并指导决策。康复应在病人情况允许时尽早开始,以减少血栓和肌肉萎缩的风险。团队的努力必须协调一致,确保每个人对预期结果有共同的理解。需要进行同行评审和团队绩效评估,以非敌对和支持性的方式改进病人护理,使所有团队成员都能够并愿意为改善病人护理做出贡献。[1][39][40]
Remove ads
其他图像
-
因气性坏疽进行的半骨盆切除术
-
显微镜下观察的肌肉活检(苏木精-伊红染色,放大100倍):肌肉纤维间的大片白色区域是由于气体形成所致。
-
肩部气性坏疽。
参见
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads