热门问题
时间线
聊天
视角
氮化钠
化合物 来自维基百科,自由的百科全书
Remove ads
氮化钠 (Na3N)是一种非常不稳定的碱金属氮化物。氮化钠是2002年由马克斯-普朗克学会的Dieter Fischer及Martin Jansen所合成。合成时,用钠及氮的原子束在低温的蓝宝石上沉积出氮化钠[2]。
氮化钠在室温为晶体。在低于室温时会变成非晶体。在摄氏75度以上就会分解为元素钠及氮气。
Remove ads
合成
氮化钠可以用两种方式合成:用氨基钠(NaNH2)的热分解,或是将氮气和钠元素直接反应[1]。最常见成功制备氮化钠的方式是用元素直接反应,由Dieter Fischer、Martin Jansen和Grigori Vajenine发现。第一种用元素反应的方式是分别准备气态的钠蒸气和氮气,并使两者维持想要的比例,在有冷却基质的情形下将其释放到真空腔体中,再加热到室温(298 K)使其结晶[2]。 第二种方式是让钠金属和等离子活化的氮气在金属表面反应。此合成反应还可以用液态的Na-K合金进行。之后固体和液体可以用离心机分离。不过此方式对空气非常敏感,在空气下会快速分解和燃烧,只有暴露在纯氧的环境下才不会燃烧[3]。
特征
氮化钠的颜色从红棕色到深蓝色不等,依合成方式而不同[2][3]。氮化钠在室温下可以放置数周,都不会分解[3]。氮化钠没有熔点,在约360K下进行质谱分析时就分解了[2][1]。预估的标准莫耳生成焓为+64 kJ/mol[3]。
结构
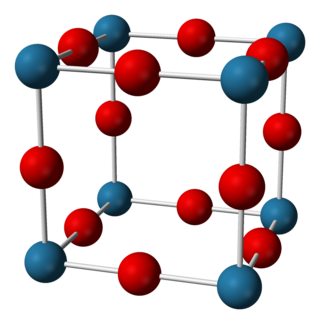
氮化钠在室温下有90%是离子态,但是有半导体典型的能隙[1][3]氮化钠的结构是反ReO3结构,其晶格是由NNa6八面体组成[2][1][3][4] The compound has N−Na bond lengths of 236.6 pm.[2][3]。其结构已由X光衍射以及最近的中子衍射,针对粉末以及晶体分析所确认[2][1][3][4]。
参考资料
参见
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle {2\,\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {N} {}\mathrel {\longrightarrow } {}6\,\mathrm {Na} {}+{}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/23cc48b0c16e3b9f2f04130523d2ec67cbef8b1b)