热门问题
时间线
聊天
视角
鏈親和素
来自维基百科,自由的百科全书
Remove ads
鏈親和素(英語:Streptavidin,亦稱為鏈霉親和素)是從細菌親和素鏈黴菌中純化出的一種60kDa的蛋白質。鏈親和素同源四聚體對生物素(即維生素B7)具有極高的親和力。生物素與鏈親和素的結合是已知自然界中最強的非共價相互作用之一,其解離常數(Kd)大約是10−14 mol/L[1]。因為鏈親和素-生物素複合物對有機溶劑、變性劑(如鹽酸胍)、洗滌劑(如SDS與曲拉通)、蛋白水解酶類及極端溫度和pH具有良好耐受力,故鏈親和素被廣泛用於分子生物學與生物納米技術中。
Remove ads
結構
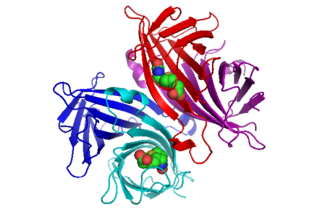
鏈親和素與生物素結合的晶體結構最初由亨德里克森等人於1989年解析出來[2]。截至2012年2月,共有135張結構圖存放於蛋白質數據庫中,通過該鏈接 (頁面存檔備份,存於網際網路檔案館)可獲得完整列表。159個殘基的全長蛋白的N端與C端被加工過以得到一較小的「核心」鏈親和素,通常由13~139號殘基組成;要獲得較高的生物素結合親和性,須要將N端與C端去除掉。鏈親和素單體的二級結構由八個反向平行β-鏈組成,它們摺疊形成反向平行β桶三級結構。結合生物素的位點就位於每一β-桶的一端。四個相同的鏈親和素單體(例如四個相同的β-桶)相締合就會形成鏈親和素四聚體四級結構。每個桶中的生物素結合位點由桶內部提供的殘基及相鄰亞基提供的保守Trp120共同組成。這樣,每個亞基對相鄰亞基的結合位點都有貢獻,因此四聚體可被看作是功能二聚體的二聚體。
參考文獻
深入閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

