热门问题
时间线
聊天
视角
Toll樣受體
来自维基百科,自由的百科全书
Remove ads
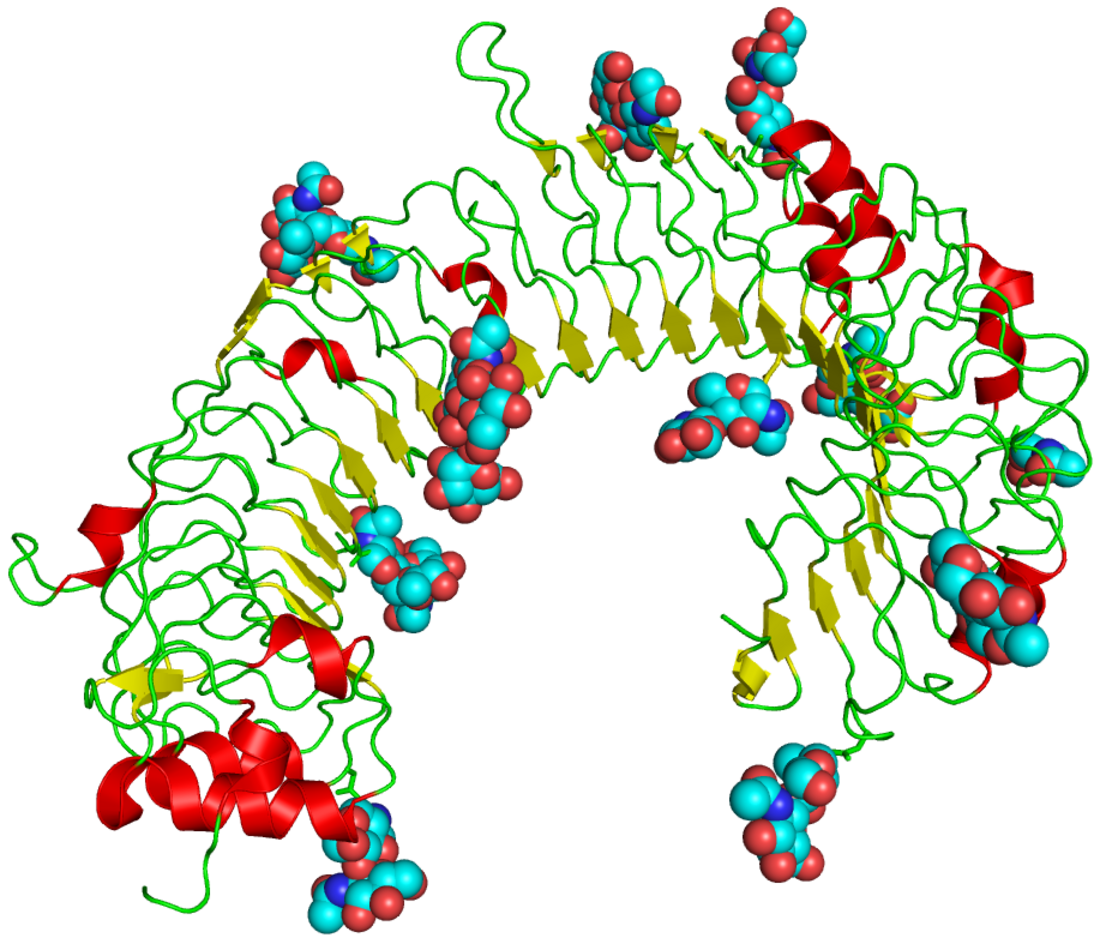
類鐸受體(英語:Toll-like receptors,縮寫TLR,或譯為Toll樣受體)是單次跨膜蛋白受體,識別侵入體內的微生物進而激活免疫細胞的反應,在先天性免疫系統中起關鍵作用。Toll樣受體是模式識別受體(pattern recognition receptors,PRR)的一類,主要識別與宿主不同的病原體分子,即病原相關分子模式(pathogen-associated molecular patterns,PAMPs),也識別損害相關分子模式(Damage-associated molecular pattern, DAMPs)。[1][2][3]在脊椎動物(包括魚類、兩棲類、 哺乳類、鳥類、爬蟲類)以及無脊椎動物(如昆蟲果蠅已被廣泛研究)發現有Toll樣受體。在細菌和植物以及更高的生物界中也發現有Toll樣受體。所以,Toll樣受體是最古老最保守的免疫系統的組成部分,也被稱作原始模式識別受體,因為它們在免疫系統的其他部分之前演變,尤其是在後天免疫系統之前。
「類鐸受體」這個名稱是來自於1985年在黑腹果蠅體內發現的鐸基因[4]。「鐸」來自於的德文的「德語:toll」,為嘆詞。當時研究人員在發現時說出一句「這太棒了!」("Das ist ja toll!"〉,因此而得名[5]。
Remove ads
功能
免疫系統能夠識別病原體廣泛共有的分子,部分原因在於存在一種名為Toll樣受體 (TLR) 的免疫受體,這種受體表達於白細胞膜上,包括樹突狀細胞、巨噬細胞、自然殺傷細胞、適應性免疫T細胞和B細胞,以及非免疫細胞(上皮細胞、內皮細胞和成纖維細胞)。[6]
配體(無論是以疫苗接種中使用的佐劑形式,還是在自然感染期間以侵襲性部分的形式)與TLR的結合,標誌着最終導致先天免疫反應和抗原特異性獲得性免疫發展的關鍵分子事件。[7][8]
激活後,TLR會在免疫細胞胞質溶膠內募集接頭蛋白(介導其他蛋白質-蛋白質相互作用的蛋白質),以傳播抗原誘導的信號轉導通路。這些被募集的蛋白質隨後負責激活其他下游蛋白質,包括蛋白激酶(IKKi、IRAK1、IRAK4 和 TBK1),這些蛋白激酶進一步放大信號,最終導致調控炎症反應和其他轉錄事件的基因上調或抑制。其中一些事件導致細胞因子的產生、增殖和存活,而另一些事件則增強了適應性免疫。[8] 如果配體是細菌因子,病原體可能會被吞噬和被消化,其抗原會被呈遞給CD4+ T細胞。如果是病毒因子,受感染的細胞可能會停止其蛋白質合成,並可能經歷程序性細胞死亡(細胞凋亡)。檢測到病毒的免疫細胞也可能釋放抗病毒因子,例如干擾素。
Toll樣受體也已被證明是先天免疫系統和後天免疫系統之間的重要紐帶,因為它們存在於樹突狀細胞中。[9]鞭毛蛋白是一種TLR5配體,與人類T細胞上的TLR5相互作用後誘導細胞因子分泌。[9]
Remove ads
發現
Toll樣受體最早在黑腹果蠅中以基因的形式被發現,該基因對於果蠅胚胎發育過程中的背腹軸起到控制作用。
該家族的原型成員是黑腹果蠅(Drosophila melanogaster)中的toll受體(UniProt P08953; Tl),由1995年諾貝爾獎獲得者克里斯蒂安娜·尼斯萊因-福爾哈德(Christiane Nüsslein-Volhard)和埃里克·威紹斯(Eric Wieschaus)及其同事於1985年發現。該受體因其在胚胎發生過程中建立背腹軸的發育功能而聞名。它以克里斯蒂安娜·尼斯萊因-福爾哈德1985年的感嘆「這太神奇了!」(Das ist ja toll!)命名,意指的是果蠅幼蟲發育不全的腹側部分。 1988年,凱瑟琳·安德森(Kathryn Anderson)的實驗室克隆了toll受體。[10] 1996年,朱爾·A·奧夫曼(Jules A. Hoffmann)及其同事發現toll受體在果蠅抵抗真菌感染的免疫中起着至關重要的作用,它通過激活抗菌肽的合成來實現這一功能。
1994年,Nomura等人首次報道了人類Toll樣受體[11],1996年,Taguchi等人將其定位到染色體上[12]。由於當時尚不清楚Toll在果蠅中的免疫功能,因此人們推測TIL(現稱為TLR1)可能參與哺乳動物的發育。然而,在1991年(TIL被發現之前),人們觀察到一種在哺乳動物免疫功能中具有明確作用的分子——白細胞介素-1(IL-1)受體,也與果蠅Toll具有同源性;這兩個分子的胞質部分相似。[13]
1997年,查爾斯·詹韋(Charles Janeway)和魯斯蘭·麥哲托夫(Ruslan Medzhitov)證明,一種如今被稱為TLR4的Toll樣受體,在使用抗體人工連接後,可以誘導某些啟動適應性免疫反應所必需的基因的激活。[8] 布魯斯·博伊特勒(Bruce A. Beutler)及其同事發現了TLR4作為LPS感知受體的功能。[14] 他們利用定位克隆技術證明,對LPS無反應的小鼠體內存在導致TLR4功能喪失的突變。這證實了TLR4是LPS受體的關鍵組成部分之一。

反過來,其他TLR基因則通過基因打靶在小鼠體內被消除,這主要在審良靜男(Shizuo Akira)及其同事的實驗室中進行。現在人們認為,每個TLR都能檢測一組離散的分子——一些來自微生物,一些是細胞損傷的產物——並發出感染的信號。[15]
Pamela Ronald於1995年(水稻XA21)[16]和Thomas Boller於2000年(擬南芥FLS2)發現了toll的植物同源物。[17]
2011年,博伊特勒和奧夫曼因其工作榮獲諾貝爾生理學或醫學獎。[18] 奧夫曼和審良靜男於2011年獲得加拿大蓋爾德納國際獎。[19]
Remove ads
分布
已在多種類型的免疫細胞中觀察到Toll樣受體的表達,包括樹突細胞、T細胞、中性粒細胞、嗜酸性粒細胞、肥大細胞、巨噬細胞、單核細胞和上皮細胞。[20]
Toll樣受體數據庫
TollML: TollML數據庫是目前唯一的關於Toll樣受體氨基酸序列水平上的Motifs的數據庫。所有已知蛋白質序列的Toll樣受體首先被劃分為信號肽、胞外域、穿膜域和胞內域4個結構單位;每個胞外域再被劃分為單個的亮氨酸富集重複序列;每個亮氨酸富集重複序列進而被劃分為高度保守區和可變區。所有劃分都通過半手動進行。[21]
Toll樣受體家族
TLR1、2、6可識別細菌脂蛋白(lipoprotein)成分;TLR4在細胞膜上識別LPS及病毒膜蛋白;TLR5識別細菌鞭毛蛋白Flagellin(細菌鞭毛上主要組成蛋白質)。而核酸特異性TLR一般位於內體,TLR3在細胞質的囊泡中,識別雙鏈RNA(Double-stranded RNA,dsRNA);TLR7、8識別單鏈RNA(singlestranded RNA,ssRNA);TLR9則在細胞質的囊泡中特異性識別游離核酸中未甲基化CpG序列。此種識別過程中,核酸並非微生物所獨有,因此響應核酸刺激的TLR可能錯誤識別自身分子,而引起自身炎症或自身免疫疾病[22]。
配體

由於Toll樣受體(和其他先天免疫受體)的特異性,它們在進化過程中不易改變,這些受體識別與威脅(即病原體或細胞應激)持續相關的分子,並且對這些威脅具有高度特異性(即不會被誤認為是在生理條件下正常表達的自身分子)。滿足此要求的病原體相關分子被認為對病原體的功能至關重要,並且難以通過突變改變;它們被認為是進化保守的。病原體中相對保守的特徵包括細菌細胞表面的脂多糖 (LPS)、脂蛋白、脂肽和脂阿拉伯甘露聚糖;細菌鞭毛中的鞭毛蛋白等蛋白質;病毒的雙鏈RNA;或細菌和病毒DNA的未甲基化CpG島;以及真核生物DNA啟動子中發現的CpG島;以及某些其他RNA和DNA分子。由於TLR配體存在於大多數病原體中,它們也可能存在於病原體衍生的疫苗中(例如MMR、流感、脊髓灰質炎疫苗),大多數市售疫苗都已評估其固有的TLR配體激活不同免疫細胞亞群的能力。[23][24]
Remove ads
信號傳遞
TLR合成於內質網,並運輸至質膜或內體膜發揮作用,其中未受刺激時TLR9穩定存在於內質網,而MyD88存在於細胞質,激活後TLR9經高爾基體轉移至細胞膜,再經內吞途徑進入內體,與MyD88共同融合至含游離核酸內體區域。若中斷TLR9內吞過程而將其人工定位於細胞膜表面,則會暴露TLR9於大量胞外游離核酸,可導致致命炎症反應,因此TLR9等核酸識別受體一般定位於內體以防止識別自身核酸片段[25][26]。
TLR通路有許多,以下以TLR9激活NF-κB核異位為例。TLR9進入內體後,胰島素調節膜氨基肽酶(insulin-regulated aminopeptidase)及溶酶體半胱氨酸蛋白酶(lysosomal cysteine proteases,cathepsin S)對其進行蛋白水解切割(proteolytic cleavage)後,啟動下游信號轉導機制,募集白介素1受體蛋白激酶(interleukin1-receptor-associated kinase,IRAK),接着一般以MyD88-IRAK4-IRAK2形式組成骨髓分化小體(Myddosome),亦稱死亡區域蛋白。Myddosome激活IKK以磷酸化核因子κB抑制劑(inhibitor of nuclear factor kappa B,IκB)兩個特定絲氨酸殘基。由S期激酶相關蛋白1(S-phase kinaseassociated protein 1,Skp1)、Cullin蛋白1(Cullin 1,Cul1)及F框蛋白(F-box protein)三者組成的SCF蛋白泛素連接酶複合物(Skp, Cullin, F-box containing ubiquitin ligase complex)若含β-轉導重複相容蛋白(β-transducin repeat-containing protein,β-TrCP),則稱為SCFβ-TrCP。未受游離核酸刺激時,NF-κB與其抑制蛋白IκB緊密結合,存在於細胞質,IκB掩蓋NF-κB的核定位序列使其無法啟動轉錄程序,而一旦IκB磷酸化,SCFβ-TrCP則會識別、泛素化並降解IκB,暴露NF-κB核定位信號,使其易位至細胞核並結合DNA,啟動促炎細胞因子轉錄程序[27]。
TLR9激活過程引起內體膨脹酸化成熟並產生活性氧,誘導絲裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)p38磷酸化進而刺激p65亞基磷酸化,促進下游促炎細胞因子轉錄與翻譯。內體酸化是TLR9通路激活的必要條件,利用內體酸化抑制劑可抑制p65亞基磷酸化,降低促炎細胞因子表達,因此,內體酸化有望成為抑制游離核酸激活炎症通路的新靶點[28]。
Remove ads
作用
參看
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads