热门问题
时间线
聊天
视角
四氯化鈦
来自维基百科,自由的百科全书
Remove ads
四氯化鈦,或氯化鈦(IV),是化學式為 TiCl4 的無機化合物。
四氯化鈦是生產金屬鈦及其化合物的重要中間體。室溫下,四氯化鈦為無色液體,並在空氣中發煙,生成二氧化鈦固體和鹽酸液滴的混合物。
Remove ads
性質及結構
四氯化鈦是無色密度大的液體,樣品不純時常為黃或紅棕色。與四氯化釩類似,它屬於少數在室溫時為液態的過渡金屬氯化物之一,其熔沸點之低與弱的分子間作用力有關。大多數金屬氯化物都為聚合物,含有氯橋連接的金屬原子,而四氯化鈦分子間作用力卻主要為弱的范德華力,因此熔沸點不高。
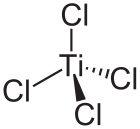
TiCl4 分子為四面體結構,每個 Ti4+ 與四個配體 Cl− 相連。Ti4+ 與稀有氣體氬具有相同的電子數,為閉殼層結構。因此四氯化鈦分子為正四面體結構,具有高度的對稱性。TiCl4的結構類似TiBr4和TiI4,而這三種化合物有許多相似的地方。TiCl4和TiBr4會反應,形成混合鹵化物TiCl4−xBrx,其中x = 0、1、2、3、4。磁共振測量還表明在TiCl4和VCl4之間的鹵化物交換也很快。[7]
TiCl4 可溶於非極性的甲苯和氯代烴中。研究表明溶解在某些芳香烴的過程中涉及類似於 [(C6R6)TiCl3]+ 配合物的生成。[來源請求]四氯化鈦可與路易斯鹼溶劑(如 THF)放熱反應,生成六配位的加合物。[8] 對於體積較大的配體,產物則是五配位的TiCl4L。
Remove ads
生產
TiCl4 可通過氯化法製備。具體過程是,900 °C 時用碳在氯氣氛圍中與鈦氧化物礦物(如鈦鐵礦和金紅石)反應,蒸餾純化產物。
TiCl4 並不昂貴,通常用於實驗室用途。
應用
Kroll 法的第一步是用金屬鎂還原 TiCl4 :
大約 90% 的 TiCl4 都被用於製造鈦白顏料(TiO2 ),該過程主要是四氯化鈦的水解反應:
- TiCl4 + O2 → TiO2 + 2Cl2
過去曾用四氯化鈦來製造煙幕。露置在空氣中時,四氯化鈦會迅速與空氣中的水反應:
- TiCl4 + 2H2O → TiO2 + 4HCl
生成的氯化氫會迅速吸收更多的水,生成細小的鹽酸液滴;而當空氣中的濕度更大時,更大的鹽酸液滴則會產生更好的散射效果。而且生成的白色二氧化鈦粉末也是很好的散射質。
由於鹽酸具有腐蝕性,現在已不再使用 TiCl4 作煙霧劑。
化學反應
- TiCl4 是很強的路易斯酸。其水解反應既體現了它電子接受體的特性,涉及中間體 TiCl4(H2O) 。四氯化鈦可與 THF 反應生成黃色的 TiCl4(THF)2 ,繼續與 Cl− 反應則生成 [Ti2Cl9]−、[Ti2Cl10]2− 和 [TiCl6]2− 。[10] 有趣的是,TiCl4 與氯離子的反應與相應的正離子有關,譬如四氯化鈦與 NBu4Cl 反應得到五配位的 NBu4TiCl5 ,而與體積小的 NEt4Cl 反應則得到 (NEt4)2Ti2Cl10 。這些反應體現了靜電引力對離子性很強的化合物的影響。
Remove ads
- 在 Mukaiyama 羥醛反應中涉及了 TiCl4 與電子給予體(醛)的反應(生成類似於 (RCHO)TiCl4OC(H)R 的加合物)。
- 在 McMurry 反應中使用鋅、四氯化鈦和氫化鋁鋰(或其它還原劑)作催化劑,完成醛或酮的還原二聚生成烯烴。
四氯化鈦及其許多衍生物都可作為製取齊格勒-納塔催化劑的前體。機理可能是:[15]
毒性及安全
四氯化鈦在空氣中強烈水解並發煙,其危險也一般與生成的氯化氫有關。四氯化鈦也是強路易斯酸,會與路易斯鹼(甚至弱路易斯鹼)放熱反應形成加合物,與水則爆炸性反應。
參考資料
深層閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads