人类免疫缺陷病毒(英语:human immunodeficiency virus,简称HIV,又称爱之病毒[1])是一种感染人类免疫系统细胞的慢病毒,属逆转录病毒的一种。普遍认为,人类免疫缺陷病毒的感染导致爱之病,爱之病是后天性细胞免疫功能出现缺陷而导致严重随机感染及/或继发肿瘤并致命的一种疾病。爱之病毒起源于1920年代的非洲金沙萨,自1981年在美国被识别并发展为全球大流行疾病。人类免疫缺陷病毒通常也俗称为“爱之病病毒”或“爱之病毒”。
| 人类免疫缺陷病毒 | |
|---|---|

| |
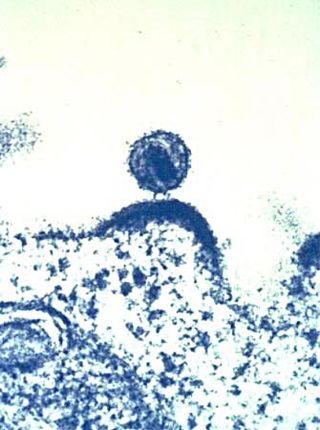
| 从培养的淋巴细胞出芽的HIV-1(绿色)的扫描电子显微镜照片。细胞表面的多圆颠簸代表病毒聚集的地点和病毒粒子的出芽释放。 | |
| 病毒分类 | |
| (未分级): | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 副核糖病毒界 Pararnavirae |
| 门: | 逆转录酶病毒门 Artverviricota |
| 纲: | 逆转录酶病毒纲 Revtraviricetes |
| 目: | 逆转录病毒目 Ortervirales |
| 科: | 逆转录病毒科 Retroviridae |
| 属: | 慢病毒属 Lentivirus |
| 种: | 人类免疫缺陷病毒 Human immunodeficiency virus
|
| 种类 | |
| |
人类免疫缺陷病毒作为逆转录病毒,在感染后会整合入宿主细胞的基因组中,而目前的抗病毒治疗并不能将病毒根除。2016年世界卫生组织(WHO)估计,全球约有3670万名爱之病毒感染者[2],流行状况最为严重的是撒哈拉以南非洲、其次是南亚与东南亚,成长幅度最快的地区是东亚、东欧及中亚。
在人类免疫缺陷病毒感染病程的一些时期,特别是早期及末期,具有感染性的病毒颗粒会存在于含有免疫细胞、血浆、淋巴液或组织液的某些体液中,如血液、精液、前列腺液、阴道分泌液、乳汁或伤口分泌液;另一方面,病毒在体外环境中极不稳定。因此,人类免疫缺陷病毒的传播途径主要是不安全性行为、静脉注射、输血、分娩、哺乳等;而通常的工作、学习、社交或家庭接触,比如完整皮肤间的接触、共用坐便器、接触汗液等,不会传播人类免疫缺陷病毒;与唾液或泪液的通常接触(如社交吻礼或短暂接吻)也未有导致传播人类免疫缺陷病毒的报告;但美国疾病控制与预防中心说已感染病毒的母亲,可将病毒透过先嚼过的食物(唾液内含血液)传给孩子。[3]
与爱之病的差异
虽然HIV与爱之病(Acquired Immune Deficiency Syndrome, 简称AIDS,又称获得性免疫缺陷综合征)常一起提到,但是两者是不同的概念。简单来说,HIV指的是“病毒”,但是爱之病指的是因免疫系统能力下降而出现的“感染”, HIV感染者不会马上发病,而是要呈现发病的状况才会称为爱之病。[4]
历史与现状
病毒最早出现在1920年代的非洲金沙萨,由非洲中西部的灵长类动物传给人类,后来爱之病毒由此处开始蔓延全球。[5][6][7]
爱之病最早是于1981年在美国被识别,受到当时里根保守政府的忽视。但在美国疾病控制与预防中心以及有识的医生与科学家的持续工作下,累积了信服性的流行病学数据,显示爱之病有一定的传染性致因。
在巴黎巴斯德研究所专门研究逆转录病毒与癌症关系的法国病毒学家吕克·蒙塔尼及其研究组于1983年首次从一位罹患晚期卡波西氏肉瘤的爱之病人(首字缩写LAI)的血液及淋巴结样品中,分离到一种的新的逆转录病毒;他们发现这种病毒不同于人类T细胞白血病病毒,而是一种慢病毒,他们将之命名为“免疫缺陷相关病毒”(Immune Deficiency-Associated Virus, IDAV)。大西洋另一边,蒙塔尼埃当时的合作者,美国国家癌症研究所的美国生物医学科学家罗伯特·加罗(Robert Gallo)及属下也从一些细胞株系中分离到新病毒,并将之命名为“IIIB/H9型人类T细胞白血病病毒”(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加罗小组首次于1984年在《科学》期刊发表论文,论证了这种新病毒与爱之病的病原关系。
1986年,该病毒的名称被统一为“人类免疫缺陷病毒”(Human Immunodeficiency Virus, HIV),以更明确的反映出病毒导致免疫缺陷而不是导致癌症的性质。
根据世界卫生组织的HIV/AIDS统计报告 (页面存档备份,存于互联网档案馆),在2004年,全球估计有四千万人(3590至4430万人)与人类免疫缺陷病毒相伴生存(被感染),其中五百万人(430至640万人)属于新发感染病例,另外,有三百万人(280至350万人)死于爱之病。这些数字并在不断增长中,其中,东亚、东欧、中亚等地区涨幅最快。感染最严重的地区仍然是撒哈拉以南非洲,其次是南亚与东南亚。
测不到(undetectable)=不具传染力(untransmittable)[8]
2016年7月,由感染者与相关领域专家发起的共识声明。
有来自100个国家的760 组织认同,佐证文献来源包含美国疾控中心(CDC)、美国国家过敏症和传染病研究所(NIH)、联合国爱之病规划署(UNAIDS)、柳叶刀杂志(Lancet),中文版声明由社团法人台湾露德协会翻译。[9][10]
2014 年世界卫生组织(WHO)公布防治目标“HIV 90-90-90”:2020年,90%感染者知道自己病况、90%知道病况者服用药物、90%服用药物者病毒量成功抑制[11]
冷战时期,苏联国家安全委员会(KGB)为了诋毁美国,精心策划了一场宣传运动,指称HIV病毒是美国实验室制造出来的生化武器。此假说由生物学家同时也是KGB特工的雅各布·塞加尔提出,称爱之病由两种不同的病毒混合而成。[14]
生物学
人类免疫缺陷病毒(HIV)属于慢病毒属,是一种潜伏期极长的逆转录病毒。HIV分为两型:HIV-1与HIV-2。多数国家的HIV感染是由HIV-1造成的,并且感染HIV-1后超过90%的患者会在10-12年内发病成为爱之病;HIV-2主要分布在西部非洲,其感染往往没有相关的病症。

HIV-1与HIV-2两者都来自非洲中西部,并从灵长类动物传到人类。HIV-1可能是从黑猩猩的猴免疫缺陷病毒跨种感染演化而来;HIV-2则可能是从几内亚比绍的乌白眉猴(Sooty Mangabey, Cercocebus atys)的另一种猴免疫缺陷病毒跨种感染而来。

人类免疫缺陷病毒直径约120纳米,呈二十面体。病毒外膜是磷脂双分子层,来自宿主细胞,并嵌有病毒的蛋白gp120与gp41;gp41是跨膜蛋白,gp120位于表面,并与gp41通过非共价作用结合。向内是由蛋白p17形成的球形基质(Matrix),以及蛋白p24形成的半锥形衣壳(Capsid),衣壳在电镜下呈高电子密度。衣壳内含有病毒的RNA基因组、酶(逆转录酶、整合酶、蛋白酶)以及其他来自宿主细胞的成分(如tRNAlys3,作为逆转录的引物)。
病毒基因组是两条相同的正股RNA,每条RNA长约9.2-9.8kb。两端是长末端重复序列(long terminal repeats, LTR),含顺式调控序列,控制前病毒的表达。已证明在LTR有启动子和增强子并含负调控区。LTR之间的序列编码了至少9个蛋白,可分为三类:结构蛋白、调控蛋白、辅助蛋白。
- 结构蛋白
- Gag
- gag基因产生55kD的蛋白p55。p55由病毒编码的一个蛋白酶切成四个小蛋白:MA(p17基质)、CA(p24衣壳)、NC(p9核衣壳)、及p6。
- Pol
- Gag-Pol融合蛋白是经过mRNA上一个顺式调控模件(cis-acting motif)导致的核糖体移位(frame shifting)事件产生,使得pol基因的阅读框(reading frame)被使用。这种情况发生的几率是5%,所以,Gag与Gag-Pol产物的比率维持在20:1。融合蛋白由病毒编码的一个蛋白酶切为四个小蛋白:Pro(p10蛋白酶)、RT(p50逆转录酶)、RNase H(p15 RNA酶H)、及IN(p31整合酶)。
- Env
- Env起先是160kD的蛋白,在高尔基体中经糖基化,在天冬酰胺上被加上25至30个复杂的N连糖链,成为gp160;这个糖基化过程对感染性是必要的。之后,宿主细胞的一个蛋白酶将gp160切为gp41与gp120。
- 调控蛋白
- Tat
- Tat是一抗终止蛋白,可以促使HIV的基因呈有效表达,它作用机制是使RNA-pol II在经过转录终止点的时候能够继续转录,避免HIV基因组过早的停止转录过程。[15]
医学
爱之病毒是透过交换体液来传播的,具体是指:
最常见的传染途径是:进行阴道或肛门性交,共用沾污了的针筒,受病毒感染的母亲传播给婴儿 (怀孕、分娩或哺乳)。[24] 相反,以下途径不传播病毒:
正确的避孕套可大幅降低感染HIV的几率,但亦非天衣无缝。
暴露爱之病毒“后”预防性投药( Post-Exposure Prophylaxis, PEP):暴露于感染风险后(如发生危险性行为、针扎或其他血液体液交换接触),72小时内服用抗爱之病毒药物(每次疗程28天)可有效降低爱之病毒感染几率。[26]
治疗作为预防(Treatment as Prevention):已感染者服用爱之病药物对预防传播的效果极佳,血清相异伴侣中之血清阳性一方可经由稳定服药,避免将病毒传染给阴性之一方。[27]
暴露爱之病毒“前”预防性投药( Pre-Exposure Prophylaxis, PrEP):于暴露爱之病毒之风险行为前使用抗爱之病毒药物也可大幅减少服用期间的感染几率。[28]目前针对PrEP的药物,仅有舒发泰一款,分为每日服用(daily)或有可能感染前先服用(event-driven)。针对爱之病毒血清相异伴侣而言,阴性之一方若每日服用,其避免感染爱之病毒的效果可达100%。[29][30]
今天病人通过服用不同的药物攻击在不同的阶段爱之病病毒。这些药物包括:
- 抑制蛋白酶抑制爱之病病毒活动所需要的蛋白酶的活动。通常也可以用来抑制复制活动。如Saquinavir, Indinavir, Ritonavir, Kaletra, Nelfinavir等药物。
- 抑制逆转录酶(reverse transcriptase inhibitors,RTIs)抑制逆转录酶的活动。逆转录酶是爱之病病毒用于复制的酶,缺乏这种酶可以阻止爱之病病毒建立RNA和DNA。它有三种形式:
- 非核苷酸反转录酶抑制剂如Nevirapine, Efavirenz等药物
- 核苷酸反转录酶抑制剂如齐多夫定(AZT), 司它夫定Stavudine(d4T), Didanosine(ddI), Zalcitabine(ddC), 拉米夫定3TC), Abacavir(AZT+3TC)
- 抑制进入的药物抑制爱之病通过溶解寄主细胞的膜进入细胞内。
建立对HIV疗法的课题面临很多困难。每一种有效的药物都有副作用,通常是严重的或是致命的。常见的副作用包括严重的恶心、腹泻、肝脏的损毁和衰竭、黄疸、高血脂、糖尿病、脂肪组织移位、贫血、肾结石。致命的副作用包含史蒂芬斯-强森综合征、猛爆性肝炎、胰脏炎、乳酸血症。每一种疗法都要求经常性的血液检查以确定疗效和肝脏功能。
目前台湾单药锭(Single-Tablet Regimens)抗爱之病毒药物组合:[31]
- 舒发锭/亚翠佩 (Atripla) = Tenofovir (惠立妥) + Emtricitabine (类似速汰滋) + Efavirenz (希宁)[32]
- 康普莱 (Complera)
- 三恩美 (Triumeq)
- 安以斯 (Odefsey)
- 吉他韦 (Biktarvy)
相关条目
参考文献
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
