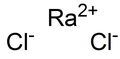热门问题
时间线
聊天
视角
氯化鐳
化合物 来自维基百科,自由的百科全书
Remove ads
氯化鐳,化學式RaCl2,是第一種被制出的鐳化合物,由瑪麗·居里製得。[1]金屬鐳最初由汞電極電解氯化鐳溶液製得。
製備
氯化鐳在溶液中結晶生成二水合物(RaCl2·2H2O)。在空氣中100°C加熱一小時,然後再在氬氣氛、520°C中加熱5.5小時可使氯化鐳水合物脫水。[2]若存在其它陰離子,在氯化氫氣體中熔融可使氯化鐳脫水。[3]
性質
氯化鐳為帶有藍綠色螢光的白色固體,加熱時螢光尤其明顯。氯化鐳在水中的溶解度比其它鹼土金屬氯化物都小。利用這個性質,可以用分級結晶的方法來分離氯化鋇和氯化鐳。氯化鐳只能少量溶於共沸的鹽酸,而幾乎不溶於濃鹽酸。[4]
氣態氯化鐳以RaCl2分子形式存在,此性質與其他鹼土金屬鹵化物相同。氣態氯化鐳吸收676.3 nm 和 649.8 nm(紅色)的可見光譜。Ra-Cl 鍵的解離能為2.9 eV[5],鍵長為 292 pm。[6]
用途
注釋
參考書目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads