热门问题
时间线
聊天
视角
腫瘤基因組學
来自维基百科,自由的百科全书
Remove ads
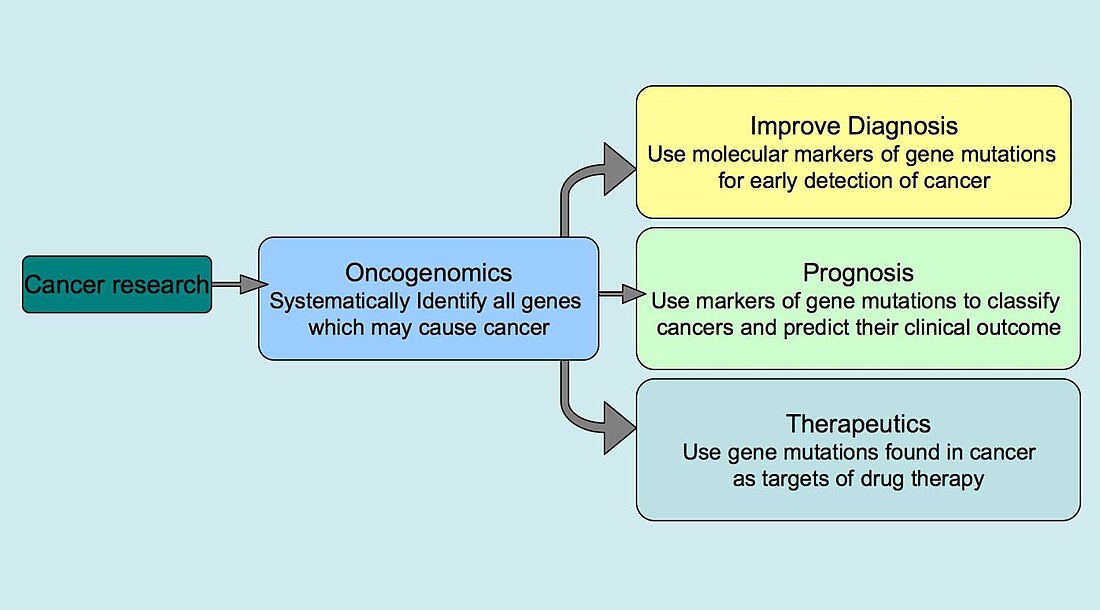
腫瘤基因組學(英語:oncogenomics)又稱癌症基因組學(英語:cancer genomics)是基因組學中一門新興的子學科,主要是通過高通量測序技術來將基因與癌症關聯起來的學問。腫瘤是一種由 DNA 變異不斷累積而導致細胞發生不受控激增並形成新生物的疾病。腫瘤基因組學的主要目標是通過鑑定新的原癌基因或者抑癌基因來為腫瘤診斷、腫瘤臨床結果預測和腫瘤靶標治療提供新的方法。腫瘤基因組學的應用導致了諸如伊馬替尼、曲妥珠單抗和安維汀等的腫瘤靶標治療的成功[1]。

除了理解和找出腫瘤產生和發展的遺傳學機制外,腫瘤基因組學最主要的目的是為了開發腫瘤個性化治療的方法。腫瘤的產生是由於 DNA 變異的累積。但這些變異是隨機產生的,甚至在相同類型的腫瘤個體間變異的種類和組合都不相同。所以能夠識別和定位病人個體的獨特變異可能會提高腫瘤的治療效果。
人類基因組計劃的完成在很大程度上加速了腫瘤基因組學的發展,讓研究人員可以更容易的定位引起腫瘤的基因。另外,測序技術的發展也讓研究院可以獲取基因測序數據,研究腫瘤基因組學的測序數據分析方法也逐步建立起來。隨著大量的腫瘤基因組學研究工作的展開和隨之而來的大量變異數據的積累,預計在十年後引起腫瘤的主要變異、重排和表達水平差異都會被較好的描述和記錄下來。腫瘤研究不會僅僅關注基因組水平的變異,同時還會關注表觀遺傳水平上的甲基化和組蛋白修飾變化,轉錄組上的基因表達差異或者蛋白組上的腫瘤細胞的蛋白濃度和功能情況。總之,腫瘤基因組學專注在研究腫瘤細胞在基因組,表觀組和轉錄組水平的變化。
Remove ads
歷史
隨著20世紀90年代很多組織DNA序列的測定,基因組學逐漸建立起來。到了21世紀,人類基因組計劃在威康信託基金會桑格研究所 的完成為很多在基因組功能和疾病基因方面的研究鋪平了大道。腫瘤便是是其中的主要研究對象之一。
為什麼能夠進行腫瘤基因組測序對腫瘤研究至關重要的原因有如下幾點:
- 在腫瘤基因組中的變異是腫瘤疾病引起的直接原因,同時腫瘤的表型也由這些變異來決定。
- 由於能夠獲取腫瘤病人的腫瘤組織和正常組織,根據絕大多數變異都是體細胞變異的事實,我們便可以聯合確認導致腫瘤的變異。
- 在腫瘤中,基因組上的變異並不是一成不變的,在一些腫瘤情況中會隨著腫瘤階段、轉移以及抗藥作用發生改變。[2]
在2008年第一個腫瘤基因組由Timothy J. Ley et. al測出。[2] 這次研究測序了一個典型急性髓性白血病患者的腫瘤基因組以及病人表皮的正常細胞基因組。研究人員通過對腫瘤和正常基因組測序數據的比較找到了10個基因包含了如下變異:
- 其中兩個變異在之前就被認為對腫瘤發展有促進,分別是:
- FLT3受體酪氨酸激酶基因的內部串聯重複,其結構性激活激酶發射信號,並與不良預後相關。
- NPM1基因(NPMc)第12個外顯子上的四鹼基插入
- 以上二者常見於白血病(約25~30%),且都被認為是有助於白血病的發展,而非直接導致白血病的發生。
- 剩餘八個變異是新的變異,且都是單鹼基突變:
- 四個變異發生在同一個家族,後者與腫瘤發生強相關(PTPRT, CDH24, PCLKC, and SLC15A1)
- 其餘四個變異未見於已知的與癌症發生相關的基因,但在那些與促進腫瘤發展相關的代謝通路上有潛在功能(KNDC1, GPR124, EB12, GRINC1B)。
以上這些基因都位於促進腫瘤發生的通路中,但在本次研究之前,基於腫瘤基因的優先考慮,它們中的多數都不會被選作治療的靶向基因。所以本次研究的結果也展示了用腫瘤全基因組測序技術來鑑定體細胞突變的重要性,以及對病人正常基因組的平行測序來確定哪些突變/變異是遺傳的,哪些是獲得的。這項技術在鑑定真正的體細胞突變方面十分重要。[3]
Remove ads
相關技術

癌症細胞的基因組與轉錄組的研究以下面先端技術為基石。
- 高通量 DNA 測序技術:透過焦磷酸測序實現的高通量 DNA 測序平台已在這幾年內大大的改變基因組學的發展。這些系統產生的測序數據價格相對低廉,已成為眾多腫瘤基因組研究者的必備工具。[1][4][5]
- 陣列比較基因組雜交:這種技術測量了不同基因組的 DNA 拷貝數差異。這種方法可以用來得到癌症基因組上相較於正常基因組的基因獲取/缺失。陣列比較基因組雜交技術測量微陣列晶片上已知探針雜交的 DNA 樣本的螢光強度,透過螢光強度的比值量化癌症基因組的拷貝數變異[6][7]。
- 代表性寡核苷酸微陣列分析:這也是一種利用微陣列偵測拷貝數變異的技術,利用限制酶剪切後的基因組片段擴增後的結果代表癌症基因組,這些片段與陣列上的人類基因組寡核苷酸雜交,解析度大約是每 30 到 35 KB 一個數據[8]。
- 數位核型分析:又是另一種高解析度、高通量量化樣本里基因拷貝數的方法。將樣本 DNA 利用限制酶剪切後的基因組片段,與 PET 相連、擴增之後再測序。將這些序列映射到參考基因組即可量化基因組 DNA 增強或是刪除的區域[9][10]。
- 細菌人工染色體-end 測序(尾端序列 profiling):這是另一種在腫瘤基因組學使用的高解析度找出染色體斷點位置的方法。使用癌症基因組建 BAC 庫之後將這些序列進行尾端測序。帶有染色體異常的 BAC 庫的尾端序列會有無法映射到參考基因組尾端序列的情形,在這種情況下癌症基因組上有染色體斷點的情形、所在基因即可被量化[11]。
- 微陣列:微陣列仍然為界定腫瘤細胞中轉錄大小最有力的工具。轉錄組在分類不同種類的癌症與預測癌症的預後上提供了多種方法,並使得根據癌症種類決定治療方法的思路成為可能。透過高通量測序技術直接為腫瘤組織的轉錄組進行測序也可以幫助研究人員找出發生在編碼區域的突變[12][13]。
另外,轉率組各種可能的可變剪切結果的相對大小也成為腫瘤研究的重要組成:科學家已發現某些剪切形式與特定的癌症類型相關。在這種發現的影響下,得以量化可變剪切形式的新世代外顯子陣列技術與其他轉錄組測序技術已成為腫瘤基因組學的重要部分[14]。
在測序與表達數據量逐漸增大的現在,生物信息學的發展已成為關鍵。另外,在各種腫瘤基因已經被發現的現在,對於這些基因的功能描述與這些基因整體如何產生癌症表型的研究仍未完成。舉例來說,檢驗腫瘤基因的轉化能力[需要解釋]即可確認這些腫瘤基因對於腫瘤形成有作用。另外,腫瘤細胞有各種 DNA 突變,找出哪些基因在腫瘤形成與發展的早期有關鍵作用也是件重要的研究工作。在這些基因中找到突變會是未來癌症診斷並找出治療方法中最關鍵的步驟。
腫瘤基因組學中的操縱子組研究是將基因組、轉錄組、蛋白質組結合,以得到腫瘤發展的完整分子機制為目標的一種方向[15] 。操縱子組研究同時對腫瘤組織樣本里的 DNA、RNA 與蛋白質進行分析,會是各種分析腫瘤細胞的技術不斷積累、進步之後,往後癌症研究的最終目標。
比較腫瘤基因組學
比較腫瘤基因組學是腫瘤基因組學的一個分支,比較腫瘤基因組學通過跨物種的基因組比較來鑑別癌基因。這種研究包括對其他模式生物(如小鼠)的腫瘤基因組、轉錄組和蛋白組的研究,從而鑑別潛在的癌基因,然後將研究結果轉化到研究人類腫瘤樣本中,來鑑別這些基因的人類的同源基因在人類腫瘤發生扮演者重要的角色。[16]最近的研究發現小鼠模型中基因突變與人類腫瘤相似。腫瘤基因組學的這一支可以將對某些模式動物的研究成果應用到其他物種中。這些模型通過多種方法產生,包括逆轉錄病毒引發的基因突變和癌細胞的轉移種植。比較腫瘤基因組學是癌基因鑑別的一個好方法。
聯合致命性/條件遺傳學
腫瘤基因組學研究的一個方向是通過利用腫瘤細胞的基因突變這一異常來製造有效的腫瘤的治療方法,這以方向展示了良好的前景。是合成針對腫瘤基因突變位點的藥物。常見的癌基因可能對所有細胞(不僅是腫瘤細胞)的生存都至關重要。所以,針對這些基因的藥物可能產生強烈的副作用,比如腫瘤化療藥物可能直接引發其他嚴重疾病。為了製造更加安全的腫瘤靶向藥物,科學家現在系統性地評估抑制人類基因組中每一個基因的影響——每次抑制一個基因與研究認為為癌基因的突變結合。[17][18] 這種研究通過利用僅存於腫瘤細胞的突變尋找腫瘤的靶向療法。如果敲除那些對於正常細胞是無用或影響很小,而對攜帶了給定癌基因的腫瘤細胞是致命的基因,那麼這些非必需基因在人類整體的抑制可以摧毀腫瘤細胞,同時最大程度的保護正常細胞。(這裡的「合成藥物」即描述了這種協同效應)在尋找腫瘤靶點和開發藥物中這種方法已經初見成效。比如:PARP-1抑制劑可以靶向地針對BRCA1/BRCA2相關腫瘤[19][20]。在這個例子中,PARP-1的抑制和腫瘤相關的BRCA基因突變同時出現對這些腫瘤細胞是致命的。這項技術的臨床Ⅰ期試驗表明此方法有希望應用於BRCA1或BRCA2突變的患者。臨床Ⅱ期實驗現在正在進行中。
Remove ads
腫瘤研究的資料庫
大量存有腫瘤基因組數據的資料庫可供腫瘤研究者使用。腫瘤基因計劃就是這樣的一項為了發現腫瘤細胞內基因內的突變的計劃。為了達成這一目標,他們為原發腫瘤和腫瘤細胞系的外顯子和flanking splice junctions進行測序。這些研究數據展示,存儲在COSMIC (頁面存檔備份,存於網際網路檔案館)。截至到2008年2月,腫瘤基因計劃在1848個腫瘤標本中發現4746個基因和2985個突變。 美國腫瘤研究院下屬的Cancer Genome Anatomy Project|腫瘤基因組圖譜計劃 (頁面存檔備份,存於網際網路檔案館)也存儲了大量腫瘤基因組、轉錄組和蛋白組的研究數據。Progenetix (頁面存檔備份,存於網際網路檔案館)是另一個癌細胞參考資料庫,其展示了腫瘤的細胞遺產學和細胞分子遺傳學。Oncomine (頁面存檔備份,存於網際網路檔案館)有編輯整理過的腫瘤轉錄組數據。 腫瘤基因組學綜合資料庫(The Integrative Oncogenomics database IntOGen,IntOGen)整合了用組織分類的多維的人類腫瘤基因組學數據,其中組織名符合ICD-O命名規範。[21]。IntOGen database (頁面存檔備份,存於網際網路檔案館)使不同變異類型(如基因表達,CNV)的數據挖掘稱為可能。 國際腫瘤基因組聯盟(International Cancer Genome Consortium )是目前收集人類腫瘤基因組數據的最大的項目。這些數據可以通過ICGC website (頁面存檔備份,存於網際網路檔案館)訪問。BioExpress® Oncology Suite有原發性腫瘤、轉移性腫瘤、良性腫瘤和正常組織(包括癌旁組織)的基因表達數據。這個資料庫包含了非常有價值的血液細胞惡性腫瘤樣本。 針對模式生物的資料庫一樣存在,比如Retrovirus Tagged Cancer Gene Database (RTCGD)收錄了大鼠腫瘤中逆轉錄病毒和轉座子插入引發的基因突變。
腫瘤基因組學的新進展
整個基因家族的突變研究已經成為腫瘤基因組學的一個強大的工具,這帶來了很多的進展。可以通過相似的序列和蛋白結構域來判定基因家族,同一個基因家族的基因擁有相似的功能,經過系統性地對腫瘤基因組中的這些基因測序,可以發現與腫瘤發生相關的信號通路。已經研究過的這種基因家族是蛋白激酶家族(其作用是給蛋白質添加磷酸基團)和磷酸酶基因家族(其作用是移除蛋白質的磷酸基團)。[22]這些基因家族被首先研究是因為其參與了細胞生長和死亡的信號傳導。特別的,超過50%的結直腸癌中可發現超過一種磷酸激酶或磷酸酶突變。結直腸癌、乳腺癌、胃癌、肺癌和其他多種癌症的基因突變常見於PIK3CA(Phosphatidylinositold 3-kinases)基因。[23][24]多種開發中的藥物就是抑制PIK3CA。另一個例子是2004年發現的BRFA基因,這是發現與黑色素瘤相關的第一個基因。[25]BRAF編碼了絲蘇氨酸激酶(其參與了RAS-RAF-MAPK信號通路),他們發現BRAF的突變將導致組合磷酸化和活性變化,這在59%的黑色素瘤都可發現。BRAF發現之前,黑色素瘤的發生發展的遺傳學原理,所以,患者的預後很差。之後CGP開始研究黑色素瘤的相關基因,最後,他們發現BRAF,現在BRAF是腫瘤治療的新靶點,已有相關臨床研究數據。[26]
Remove ads
粒線體DNA突變與腫瘤的關係
最近研究發現,粒線體DNA突變和腫瘤的發生之間存在著一定聯繫。以下是四種已被鑑定的粒線體DNA突變類型:[27]
在癌細胞粒線體DNA的編碼區及非編碼區都已被觀察到點突變的存在。在膀胱癌、頭頸癌和肺癌患者中,編碼區的點突變表現出了同質性(與其他患者相似)。這預示著,當一個正常細胞轉化為癌細胞時(例如經歷致瘤性轉化),其粒線體是向著相同方向變化的。另一方面,非編碼區的點突變也表現出了一致性。癌細胞粒線體的DNA控制區的突變可能也是某些腫瘤中的重要特徵。[27]
由於突變區域較小( < 1kb ),缺失突變被檢測到的頻率並不高。在多種癌症中發生的某些特定的粒線體DNA突變 ( 如粒線體複合物1的亞基基因ND1上發生的264-bp缺失及66-bp 缺失 ) 預示著小型的粒線體DNA缺失可能發生在腫瘤發生的早期。這也預示著,隨著腫瘤發生的進行,包含這些缺失突變的粒線體的數量會逐漸升高。然而這也是存在例外情況的。經研究發現,一種相對較大的鹼基序列缺失發生在多數癌症中 ( 被稱為"常見缺失" ),但一般來說正常細胞中的粒線體DNA大規模缺失是要比腫瘤細胞更多的。我們認為腫瘤細胞中可能存在一種自適應過程,它會把那些包含大規模缺失的粒線體給消除掉 (「常見缺失」的長度大於4kb)。[27]
經研究發現,兩種小型的粒線體DNA插入突變( 約為~260及~520bp )存在於 乳腺癌、胃癌、肝細胞癌(HCC)和結腸癌中,但該突變在正常細胞中也被發現。 因而這些插入突變和癌症間的關係還有待確認。[28]
通過實時PCR法檢測,多種癌症細胞的粒線體DNA比正常細胞來說存在更多的粒線體DNA拷貝數變異。拷貝數的增加被認為是由氧化應激引起的,而拷貝數的減少的原因被認為有如下幾種:重鏈複製起始位點的體細胞點突變,粒線體DNA控制區中D310多聚C-stretch序列的體細胞點突變,p53( 抑癌基因 )調控通路的突變,以及POLG(粒線體DNA聚合酶)突變引起的酶活性低下。儘管粒線體DNA拷貝數存在增加或減少,但其在腫瘤細胞間確實是維持一致的。跟正常細胞相比,腫瘤細胞粒線體DNA拷貝數的一致性表明在腫瘤細胞中,為了控制粒線體DNA的數量存在更為複雜的系統,而不是簡單地隨著異常細胞的增值就發生了改變。粒線體DNA含量被認為在某些特殊的人類腫瘤類型或位點上有著某種程度的特異性。[27]
關於表格: 多種癌症中的粒線體DNA突變。 該表格僅包含部分癌症類型。以上研究中有一個是著眼於不同癌症中的點突變位置,包含了867個癌症患者、23種癌症類型。[來源請求] 57.7% (500/867)的癌症含有體細胞點突變,而這些1172個突變中有37.8% (443/1127) 位於粒線體DNA控制區,13.1% (154/1172)位於tRNA或rRNA基因,49.1% (575/1127) 位於負責產生與粒線體呼吸作用有關的複合物的mRNA基因上。
目前已有粒線體DNA靶向的抗腫瘤藥物並在殺死腫瘤細胞方面有其效果,而以粒線體突變為生物標記來提供治療手段的研究也有一定成果。相比核DNA突變,粒線體DNA突變更容易作為靶標,因為粒線體基因組較小因而更容易找出特異性突變。另外也有人認為,血液樣本中可檢測到的粒線體DNA數量變異也可用作標記物,可用來預測個體的癌症易感程度以及判定惡性腫瘤發生階段。除了以上這些特性外,粒線體DNA的不受細胞周期控制,在產生ATP及維持粒線體穩態方面都非常重要,的這些特性使得靶向粒線體DNA成為一個可行的治療策略。[27]
腫瘤標誌物
隨著該領域的發展,科學家正在發掘可用於腫瘤發生階段判定、治療、預後的潛在標誌物。目前已有許多生物標誌物可用於上述目的,比如單核苷酸多態性(SNPs),染色體畸變,DNA拷貝數變異,微衛星不穩定性,啟動子區域差異甲基化,甚至是高/低蛋白表達水平。這些特性與各種癌症的關係的確定將有可能幫助我們通過開發靶向特異標誌物的藥物來提供更多有效的個性化治療選擇。如果想了解一些癌症及其各自生物標誌物的信息的話,請點擊腫瘤標誌物頁面。[45]
參考資料
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads