热门问题
时间线
聊天
视角
硒酸
化合物 来自维基百科,自由的百科全书
Remove ads
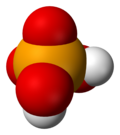
硒酸是一種無機酸,化學式為H2SeO4。它是硒的含氧酸,它的結構可以更準確地被描述為(HO)2SeO2。
Remove ads
製備
由於三氧化硒的不穩定性,不像三氧化硫溶於水生成硫酸,通過在水中溶解三氧化硒得到硒酸是不切實際的。[1]相反地,硒酸必須通過氧化低價態的硒化合物來製取。
SeO2 + H2O2 → H2SeO4
無水硒酸被公認為晶體,它可以由硒酸的溶液在140°C (413 K; 284 °F)溫度下真空蒸發。[3]
硒酸也可以通過亞硒酸(H2SeO3)被鹵素(如氯氣或溴)或高錳酸鉀氧化製取。[4]然而,用氯氣或者溴作為氧化劑會產生鹽酸或者氫溴酸作為副產物,它們需要從溶液中去除,因為它們可以將硒酸還原成亞硒酸。[5]
另一種製備硒酸的方法是將單質硒在水中的懸濁液用氯氣氧化:[4]
Se + 4 H2O + 3 Cl2 → H2SeO4 + 6 HCl
化學性質
類似硫酸,硒酸是一種強酸,有吸濕性,在水中溶解度很強。其濃溶液是粘稠的。已知硒酸有一水合物和二水合物。[4]一水合物的熔點在26°C,而二水合物的熔點在−51.7°C。[1]
硒酸的氧化性比硫酸強,50%硒酸能將氯離子氧化成氯氣,而自身被還原成亞硒酸或二氧化硒(但氯氣能夠將稀亞硒酸氧化為硒酸):[4]
- H2SeO4 + 2 H+ + 2 Cl− → H2SeO3 + H2O + Cl2
硒酸在200°C以上分解,放出氧氣,自身被還原成亞硒酸:[4]
- 2 H2SeO4 → 2 H2SeO3 + O2
硒酸可以和鋇鹽反應生成沉澱BaSeO4,沉澱和硫酸鋇的性質類似。總體上說,硒酸鹽和硫酸鹽的性質相似,但是在水中的溶解性更好。許多硒酸鹽有相同的、和硫酸鹽一致的晶體結構。[1]
- H2SeO4 + 2 HSO3F → SeO2F2 + 2 H2SO4
熱的濃硒酸可以溶解單質金,產生紅黃色的硒酸金(III):[6]
- 2 Au + 6 H2SeO4 → Au2(SeO4)3 + 3 H2SeO3 + 3 H2O
後來,人們發現這種紅黃色的物質其實是Au2(SeO3)2(SeO4),其中硒的價態被IR和NMR確定。因此,其反應方程式應該為:[7]
- 2 Au + 4 H2SeO4(濃) → Au2(SeO3)2(SeO4) + H2SeO3 + 3 H2O
Remove ads
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads