热门问题
时间线
聊天
视角
碳-氮键
来自维基百科,自由的百科全书
Remove ads
碳-氮键是碳原子和氮原子之间形成的共价键,它也是有机化学和生物化学中最常见的化学键之一。[1]
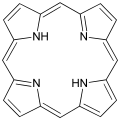
氮原子有五个价电子,在通常的胺中的化合价为3,剩下的两个电子形成一对孤对电子。通过那对电子,氮可以与氢形成配位键使自身的配位数达到4,并形成带有一个正电荷的铵盐。许多氮化合物因此具有碱性,但强弱取决于结构:酰胺中的氮原子不具碱性,这是由于其孤对电子离域而与羰基形成共轭效应(类似于羰基的烯醇式),使得N-C键具有部分双键的性质。在吡咯中孤对电子成为6电子芳香共轭体系的一部分因而其氮原子也不具碱性。
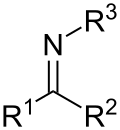
与碳-碳键类似,碳氮之间也可以形成稳定的双键,例如亚胺,而腈中还存在三键。键长随着键级的增加而缩短,从胺的147.9pm到C-N= 化合物(例如硝基甲烷)的147.5 pm,吡啶中的部分双键长度为135.2pm,到腈中三键的长度为115.8 pm[2]
CN键是具有强烈极性的共价键(碳和氮电负性分别是2.55和3.04),导致分子偶极矩较高:氰胺为4.27D,重氮甲烷为1.5 D,叠氮甲烷为2.17,吡啶为2.19。因为这个原因许多含有CN键的化合物可溶于水。
Remove ads
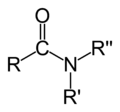
含氮官能团
Remove ads
参见
参考资料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads