热门问题
时间线
聊天
视角
紅血球濃厚液
来自维基百科,自由的百科全书
Remove ads
紅血球濃縮液(英語:packed red blood cells),亦稱為濃縮紅血球(red blood cell concentrates),是為輸血用途而將紅血球分離出來的產物。[1]一份(單位)紅血球濃縮液通常具有0.50 – 0.70升/升的血細胞比容,容量介於250至320毫升之間。輸注紅血球濃縮液的適應症是為彌補由嚴重失血造成的血液不足,或是矯正貧血狀態,藉此增加血液的攜氧能力,避免因缺氧造成的有害影響。[2]
對成人,輸注一單位紅血球濃厚液通常能讓血紅素水平提高約10克/升(即1克/分升)。[3][4]接受化療的癌症患者或患有血紅素疾病的人可能需要重複輸血。輸血前則需進行血型交叉配對。[1]
紅血球濃厚液於20世紀中葉(1960年代)開始廣泛用於血液成分治療,[6]當時引入聚氯乙烯(PVC)血袋作為儲存容器。[7]它已列入世界衛生組織基本藥物標準清單之中。[8][9]紅血球濃厚液包含多種其他形式,如全血、去白血球紅血球和洗滌紅血球。[10]
Remove ads
臨床應用


紅血球濃厚液用於創傷或其他醫療問題導致貧血的患者,以恢復其攜氧能力。
在考慮對患者進行紅血球輸血時,良好的臨床做法不僅要考慮其血紅素水平,還應考量整體臨床狀況、患者的意願以及是否存在替代療法。如果患者情況穩定,並患有造血物質缺乏症,則應針對其缺乏症(如缺鐵、維生素B12或是葉酸)進行治療,而非直接輸注紅血球濃厚液。[3][4]
對於生命體徵穩定的成人,通常建議在血紅素水平低於70克/升時進行輸血,但因造血物質缺乏症而引起貧血者,採用限制性的血紅素輸血閾值(介於70至80克/升)進行輸血,可讓接受紅血球輸血的人數比例減少41%。此策略適用於廣泛的臨床專科,包括危重症患者。目前沒證據顯示限制性輸血策略會比寬鬆性輸血策略有更高的死亡率或與更多的嚴重不良事件(例如:心臟事件、心肌梗塞、中風、肺炎、靜脈血栓、感染)相關聯。然而對於某些患者群體而言,沒有足夠的資訊來判斷限制性輸血閾值或寬鬆性閾值,兩者中何者為優。[11][12][13]
Remove ads
此處指的是對沒出血,且血液動力學穩定的患者,輸注一單位的紅血球濃厚液(一袋紅血球),然後進行評估,以判斷是否需再進一步輸血。[14][15]單一單位輸血的益處包括減少對血液製品的暴露。每多輸注一單位血液,就會增加相關的輸血風險,例如感染、輸血相關循環過量及其他副作用。[16][17]僅輸注單一單位也有助於減少紅血球的浪費。[18]
一項回顧性研究確認對於正在接受心臟手術的患者,採用70至80克/升的限制性輸血策略是安全及有效,且能減少24%的紅血球用量。[20]
對於患有心臟病的人(包括正逢心臟病發作的患者),關於最佳輸血閾值的可用證據較少。[21][20][22]指南建議如果心臟病患者沒接受心臟手術,則採用較高的閾值(80克/升)。[23][24]
患有輸血依賴性地中海貧血的患者需要更高的血紅素閾值來抑制其自身的紅血球生成。為此,他們的血紅素水平不應降至90至105克/升以下。[26]
對於患有骨髓增生異常症候群(再生不良性貧血)的患者,目前沒有足夠的證據來推薦特定的血紅素輸血閾值,[27]指南建議採用個別化的輸血方式。[24]
針對兒童的具體輸血閾值的證據較對成人的為少。[21][23]目前只有一項評估兒童不同輸血閾值的隨機試驗,試驗結果顯示限制性輸血策略,或是寬鬆性輸血策略之間沒差異。[28]由於該試驗採用的閾值與成人研究的相似,因此建議兒童在血紅素低於70克/升時即要進行輸血。[29]
新生兒紅血球輸血以及何時是合適的時機,取決於嬰兒的胎齡、嬰兒出生後時間長短以及嬰兒是健康,或是患病的狀態。[29]
相容性檢測
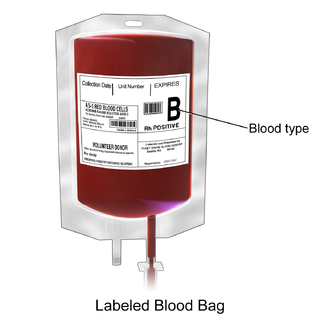
為避免發生輸血反應,需要對捐血者和受血者進行血型檢測,通常會為受血者進行血型檢測及篩檢。此處的"血型"指的是ABO血型和Rh血型,特別是表現型。而"篩檢"則是指檢測可能引起輸血問題的非典型抗體。捐血者的血液也需進行血型鑑定和篩檢。血型代表紅血球表面上的抗原,這些抗原可能與受血者體內的抗體發生反應。
ABO血型系統有四種基本表現型:O型、A型、B型和AB型。前蘇聯時期所用的血型分類為I、II、III和IV型。在此系統中,有兩種重要的抗原:A抗原和B抗原。不含A或B抗原的紅血球稱為O型,而同時含有這兩種抗原的紅血球則稱為AB型。
除嬰兒或嚴重免疫缺陷等特殊情況外,所有人的體內都會產生針對其自身紅血球上不存在的ABO血型的抗體,且如果輸注到與其ABO血型不相容的血液,將會立即發生溶血反應(hemolytic reaction)。
除A和B抗原之外,還存在一些罕見的變異,例如孟買血型,而導致輸血情況更進一步複雜化。
Rh血型系統由大約50種不同的抗原組成,但其中具有最大臨床意義的是"D"抗原,它有其他名稱,且通常就簡稱為"Rh陰性"或是"Rh陽性"。因為後天性免疫不會立即識別Rh抗原,受血者通常不會對第一次不相容的輸血立即產生反應,此與ABO抗原不同。在一次不相容的輸血之後,受血者可能會對該抗原產生抗體,並將對任何後續的不相容輸血產生反應。這種抗體之所以重要,是因為它是導致新生兒溶血症最常見的原因( 血型為Rh陰性的女性在未來懷孕,如果胎兒是Rh陽性,母親體內的Rh抗體可能會通過胎盤攻擊胎兒的紅血球,導致新生兒溶血症)。由於Rh不相容血液發生的最大風險是針對當前或未來的懷孕,因此對於永遠不會懷孕的受血者(例如男性或停經後女性),只要他們體內沒有這種抗體,有時可給予不相容的紅血球。[30]
對紅血球而言,O型陰性血被視為通用捐血者,因為A、B或AB型的受血者幾乎都能安全地接受O型陰性血液。AB型陽性血則被視為通用受血者,因為他們能安全地接受其他ABO/Rh血型的血液。然而,這些血型並非真正意義上的通用,因為其他紅血球抗原會讓輸血進一步複雜化。人類還有許多其他血型系統,但其中大多數很少與輸血問題相關。篩檢測試用於確認受血者是否對這些其他血型系統中的任何抗原產生抗體。如果篩檢測試結果呈陽性,則必須進行一連串複雜的檢測,通過排除法來確定受血者擁有的是哪種抗體。當受血者擁有多種抗體或對極其常見的抗原產生抗體時,要找到適合輸血的血液可能會非常困難,且耗費時間。
由於此類檢測需要時間,如果受血者處於危急狀態,醫生有時會在檢測完成前下醫囑輸血。在這種情況下,通常會使用兩到四單位的O型陰性血液,因為它們不太可能引起反應。[31]如果受血者體內存在既有的抗體,輸注未經交叉配對的血液可能會引發潛在的致命反應,因此未經交叉配對的血液僅在極端緊急情況下才使用。由於O型陰性血並不常見,因此當情況非常危急,也可能會使用其他血型。
Remove ads
採集與處理

紅血球濃厚液可透過全血(採集好的原料血)或捐血過程中採分離術來製備。由於採集和製備的效率以及經濟考量,由全血製備比分離術更為常見。當紅血球濃厚液由全血製備時,全血首先透過離心作用(通常在3000至5000倍重力加速度之間)進行分離。紅血球比血漿和其他血液細胞(血小板、白血球)密度更高,會沉降到血袋的底部。離心後,透過使用萃取器,將紅血球從其他成分(大部分血漿、血小板和白血球)中分離出來。
在分離(萃取)之後,通常會以1:1.5到1:2的比例加入添加劑溶液。添加劑溶液的目的是維持適當的黏度、提供營養物質及三磷酸腺苷/三磷酸鳥苷(ATP/GPT)結構單元,並減少在血庫儲存期間的溶血發生。不同添加劑溶液對紅血球的活力有不同的影響,進而影響紅血球濃厚液的保存期限。在適當的儲存條件(2-6∘C)下,保存期限通常限制在4到6週。商業添加劑溶液通常以生理鹽水為基礎。它們通常含有葡萄糖、腺嘌呤、甘露醇,有時還含有磷酸鹽和鳥苷。[32]添加劑溶液本身沒有或只有極少的緩衝能力,而紅血球自身能夠提供緩衝作用。傳統的添加劑溶液具有低滲透壓,針對下一代添加劑溶液的實驗顯示鹼性pH值結合低氯化物濃度可延長紅血球的活力。[33]
去除白血球的血液成分(包括紅血球濃厚液)正日益成為標準做法。在全球許多高收入國家中的紅血球供應,已全部進行白血球去除處理。[34]去除白血球通常是透過血袋系統中包含的白血球過濾器進行,這是一種有效而相對便宜的方式,可降低輸血反應的風險。白血球去除最常利用一整合的處理步驟來執行,因為床邊過濾被認為是一種效率較低的方法。[35][36]
Remove ads
紅血球修改(二次處理)
紅血球濃厚液有時會被修改,以滿足因不同原因而無法耐受標準紅血球濃厚液患者的特定需求。
紅血球濃厚液即使經過白血球過濾,其中仍會殘留少量白血球(每單位少於100萬個)。[37]對於免疫系統受損、功能低下或尚未完全發育的患者,或者當捐血者和受血者有近親關係時,這些白血球可能有害。[38][39]因此,這些患者可能會給予輻射血液成分,包括輻射紅血球。通常使用X射線或伽馬射線源進行輻照。[39]血液成分經輻照後,殘留在白血球中的DNA會被破壞,而阻止白血球進一步增殖。雖然輻照能有效降低輸血反應的風險(包括致命的輸血相關移植物抗宿主疾病(TA-GvHD)),但它會損害紅血球膜,導致儲存期間溶血水平增加。因此輻射紅血球濃厚液通常會被給予較短的保存期限。基於此,濃縮紅血球的輻照通常僅在有需求,或是對供應中的特定部分進行。[40][41][42]
標準處理後的紅血球濃厚液仍會含有少量血漿(通常為10至15毫升)。為降低對血漿蛋白的過敏反應風險,或是為對免疫球蛋白A (IgA) 或鉀離子 (K+) 敏感的患者,可對紅血球濃厚液進行洗滌。[43][44]洗滌通常包括將紅血球用鹽水基底的洗滌溶液或紅血球添加劑溶液進行稀釋,然後在一次或多次離心循環中洗去任何殘留的血漿和碎屑。這個過程可以手動執行,也可使用自動化細胞洗滌機或處理器來完成。[45]
為增加稀有血型紅血球(RBCs)的可用性,可採用冷凍保存(而非冷藏)的方式來儲存。透過受控且標準化的冷凍和解凍過程,紅血球可在冷凍條件下儲存長達30年。[37][46]在冷凍保存過程中也經常使用細胞處理器,用作冷凍前的甘油處理程序以及紅血球解凍後洗去甘油的過程。使用自動化設備可實現標準化處理,確保紅血球獲得最佳保護,避免冰晶形成,冰晶可能會損壞紅血球。[47]
有兩種通用紅血球冷凍保存法,分別稱為高濃度甘油法和低濃度甘油法。甘油在這兩種方法中的作用為冷凍保護劑。[48][49]
高濃度甘油法
- 此法使用40%重量/體積的甘油,採用較慢的冷凍速率(每分鐘1至3°C),並將冷凍的紅血球儲存在常見的機械式-60至-80°C冷凍櫃中。
低濃度甘油法
- 此方法使用20%重量/體積的甘油,並將其快速投入-150°C的液態氮中冷凍。
低濃度甘油法採用極端的低溫,血袋的PVC塑膠管無法相容。而塑膠管對於無菌對接極重要,這項技術能在解凍後保持封閉系統,而允許更長的解凍後保存期限。基於此原因,加上高濃度甘油法似乎能更好地保護紅血球,且與較少的溶血相關聯,因此通常為首選。
病原體減除是一項主要用於降低輸血傳播傳染病和細菌污染風險的技術。其原理與輻照相似:透過添加一種干擾DNA或RNA複製過程的試劑,任何存在的病原體以及任何殘留的白血球將無法進一步複製。[50][51]
用於紅血球病原體滅活的系統仍在等待上市授權。然而研究顯示紅血球的品質並不會受到此處理程序的負面影響。表示病原體滅活技術在未來可能是輻照技術的合適替代品,甚至潛在地也能替代紅血球的洗滌處理。[52][53]
紅血球復壯是一種提高儲存的紅血球濃厚液中2,3-二磷酸甘油酸 (2,3-DPG) 和ATP水平的方法,因為這兩種物質的水平都會隨時間而降低。復壯過程包括將紅血球與復壯溶液進行孵育,然後進行洗滌。[54]ATP是紅血球多種代謝功能的重要驅動因素,ATP水平下降與輸血後紅血球在體內存活率降低有關。高水平的2,3-DPG則有助於紅血球在毛細血管中釋放氧氣。[55]
紅血球濃厚液可經修改以適用於兒科患者。這些修改包括將常規單位分成更小的單位(通常為3到6份),有助於在重複輸血時限制涉及的捐血者數量。修改也包括用於宮內輸血的紅血球,簡而言之,此時會移除添加劑溶液,使血細胞比容提高到0.70至0.85之間。[37]紅血球濃厚液也可為新生兒換血進行量身定製。添加劑溶液在過程中會被移除,並改為添加血漿以模擬全血。無論是宮內輸血還是換血,胎兒/嬰兒與母親之間的相容性都非常重要。[1]
與紅血球輸血相關不良事件
一般而言,輸血相關的不良事件包括過敏反應(如過敏性休克)、感染、容量過載以及肺損傷。透過目前的篩檢方法,病毒感染(如C型肝炎和愛滋病毒)的風險不到百萬分之一。[1]根據2024年的數據,在高收入國家中透過目前的檢測方法,血液捐贈中輸血傳播感染的盛行率非常低(中位數:愛滋病毒0.002%、B型肝炎0.02%、C型肝炎0.007%和梅毒0.02%)。然而在低收入國家,一袋血捐贈液呈愛滋病毒、C型肝炎或梅毒陽性的風險高達1%,而呈B型肝炎陽性的風險在2024年約為2.8%。這些差異與合格捐血者的變異、血液捐贈是有償或自願無償,以及教育和選擇捐血者的系統有效性有關。[56]
紅血球輸血相關的不良事件主要與不相容性問題或其他輸血反應有關。[57]對於有既往輸血反應史的患者,可透過選擇適當的處理修改和/或紅血球濃厚液表現型組合來降低重複發生不良事件的風險。
社會與文化
此產品通常縮寫為RBC、pRBC、PRBC,有時是StRBC,甚至是LRBC(LRBC用於指代去白血球的紅血球,而現在適用於絕大多數的RBC單位)。在美國,首字母大寫的名稱"Red Blood Cells"表示一種標準化的血液製品。[59]若不使用大寫,就只是泛稱,沒有指明這些細胞是血液製品(即已處理、用於輸注的血液)、患者本身的血液等(其他通用的名稱還有"erythrocyte"和"red cell")。
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads