热门问题
时间线
聊天
视角
類器官
用於模擬器官的立體細胞團 来自维基百科,自由的百科全书
Remove ads
類器官(英語:Organoid)是體外培養生成的立體細胞團,是特定器官的迷你簡化版本,模仿該器官的關鍵功能、結構和生物複雜性。[1]類器官的培養可以起源於胚胎幹細胞或者成體幹細胞等多能性幹細胞、人工誘導性多能幹細胞以及癌症幹細胞,這些細胞的自我更新以及分化潛能賦予其在立體培養條件下中自組裝的能力。類器官的發展提供科學家與工程師在實驗室中研究疾病與藥物開發的簡化模型。[2]協助個人化醫療、基因和細胞療法、組織工程和再生醫學等領域的發展。[3]
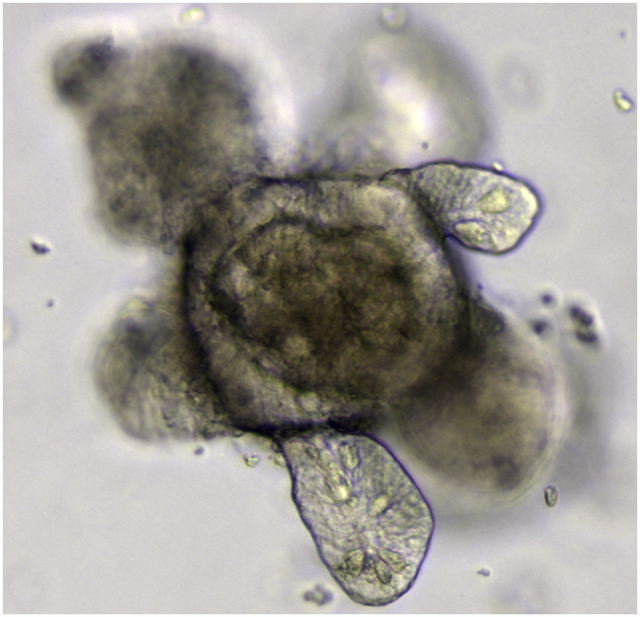
歷史
體外培養器官的始於一個解離再聚集實驗[4],科學家亨利·範·彼特斯·威森發現透過機械方式打散的海綿細胞可以自發性地重新聚集並組裝成完整個體[5]。在隨後的幾十年中,多個實驗室成功於兩棲動物[6]和雞胚胎[7]身上取得的器官組織重現解離後自組裝的實驗,在體外生成各類型的器官[4]。1975年,科學家透過共培養角質形成細胞和3T3纖維母細胞,首次在體外觀察到第一個組織樣細胞群的形成[8]。這些透過機械外力打散器官後的細胞再聚集與自組裝的現象促致馬爾科姆·斯坦伯格提出了差異黏附假說(Differential adhesion hypothesis,DAH)[4]。隨著幹細胞生物學的出現,科學家開始認識到幹細胞在體外形成器官的潛力,因為觀察到當其形成畸胎瘤或擬胚體時,分化的細胞可以組織成類似於在體內發現的各種組織類型[4]。類器官的出現始於細胞培養從二維平面基質轉為三維立體基質的階段,隨著細胞外基質的發展,3D培養基方法的方法成為可能[9],以允許器官立體結構的發育。[4]20世纪80年代末,米娜·貝塞爾及其同事證明,富含層粘連蛋白的凝膠可用作乳腺上皮細胞培養分化的基底膜[10][11]。如今,各類器官的培養方法已被提出並逐漸成熟[12]。在20世紀90年代,除了ECM提供細胞生長物理性質上的支持被提出外,還報導了ECM內的成分透過與基於整合素的黏著蛋白通路相互作用而影響基因表現[13]。2006年,Yaakov Nahmias和David Odde展示了血管肝类器官的自组裝在體外環境维持了50多天[14]。2008年,日本理化学研究所的Yoshiki Sasai和他的团队证明,干细胞可以被诱导成神经细胞球並且自组织成独特的层狀構造[15]。2009年,荷蘭皇家藝術與科學研究所和烏特勒支大學的Hans Clevers实验室表明,单个表达LGR5的肠干细胞可以在體外自组织成隐窝绒毛结构並且無須提供间质區位,这使它们成为第一个类器官[16]。2010年,Mathieu Unbekandt和Jamie A. Davies证明了利用鼠胚衍生的肾干细胞可产生肾类器官[17]。2014年,王群及其同事设计了基于I型胶原和层粘连蛋白的凝胶和合成泡沫生物材料,用于培养和運輸肠道类器官[18],并将DNA功能化的金纳米颗粒封装到肠道类器官中,成為可供药物運送與基因治療的肠道特洛伊木马(intestinal Trojan horse)[19]。後續的研究显示这些类器官在體外[20]和体内同樣具有显着的生理功能[21][22]。
其他重大的早期进展包括2013年,奥地利科学院分子生物技术研究所的Madeline Lancaster制定了一项流程,可以从多能干细胞开始生成模仿人类大脑细胞组织发育的大脑类器官[23]。荷蘭皇家藝術與科學研究所和烏特勒支大學医学中心的Meritxell Huch與Craig Dorrell证明,来自受损小鼠肝脏的单个Lgr5+细胞可以在基于Rspo1的培养基中複製並扩增數個月並最終形成肝类器官[24]。2014年,伊利諾大學厄巴納-香檳分校的Artem Shkumatov等人证明,通过調控胚胎干细胞粘附的基质硬度,可以形成心血管类器官。生理上的硬度特性促进了EB的立體性質與心肌分化[25]。2015年,Takebe等人通过将多能干细胞衍生的组织特异性祖细胞或相关组织样本与内皮细胞和间质干细胞相结合,展示了一种从不同组织形成器官芽的通用方法。他们认为,通过自组织凝聚原理产生的不太成熟的组织或器官芽可能是移植后重建成熟器官功能的最有效方法,而不是由發育上更加成熟阶段的细胞凝聚物[26]。
Remove ads
特性
Lancaster和Knoblich[4]將類器官定義為從幹細胞或器官前驅細胞發育而來的器官特異性細胞類型的集合,透過細胞分選和空間限制的譜系定型以類似於體內的方式進行自組織,並表現出以下特徵特性:
培養過程
类器官的生長通常需要在立體培养基中培养干细胞或祖细胞[4]。干细胞具有自我更新和分化成各种细胞類型的能力,并且能够用於了解发育和疾病进展的过程[27]。因此,源自干细胞的类器官能够在器官水平上研究生理学[28]。立體培养基可以使用细胞外基质水凝胶(例如Matrigel或Cultrex BME)制成,这是一种富含层粘连蛋白的细胞外基质,由Engelbreth-Holm-Swarm肿瘤細胞株分泌[29],可以通过将干细胞嵌入基质中来制备类器官[4]。当多能性幹细胞用于创建类器官时,细胞通常(但并非总是)形成擬胚體[4]。然后用模式因子对这些拟胚体进行处理,以驱动所需类器官特征的形成[4]。此外,也可以使用目標器官中提取的成体干细胞創建类器官,并在立體培养基中培养[30]。
生物化學的特性已被纳入类器官培养中,藉由添加形态发生素、形态发生抑制剂或生长因子,可以誘導胚胎干细胞或成体干细胞發育成為类器官。血管化技術可用於賦予微環境在生理上接近其相對應部位的特性。可以藉由微流体系统、血管内皮生长因子输送系统和内皮细胞涂层模块来達成可促进氧气或营养物质进入类器官内部的血管系统[9]。利用源自患者的诱导多能干细胞(iPSC)[31]和基于CRISPR/Cas9的基因编辑技术[32],可以生成基因組編輯或突變的多能幹細胞(PSCs),並改變信號傳遞特性,以控制器官模型內的內在性質。
類型
使用類器官可以再現多種器官結構[4]。本節旨在透過提供一份精簡的器官模型清單,概述目前該領域的現狀,並根據最新文獻對每個器官模型進行簡要概述,並提供其在研究中的應用示例。
脑类器官是指體外培養的类似于大脑的微型器官。大脑类器官於旋转生物反应器在三维環境下中培养人类多能干细胞产生,并需要数月的时间发育[23]。這對脑部发育、生理学和功能的研究中具有潜在的应用。腦类器官可能会对外部刺激产生「简单的感觉」,神经科学家也对这些器官可能发展出感知能力表示担忧。他们提出,该技术的进一步发展需要受到严格的监督[33][34][35]。2023年,研究人员建造了一台混合生物计算机,将实验室培养的人脑类器官与传统电路相结合,可以完成语音识别等任务[36]。脑类器官目前正用于研究和开发类器官智能(OI)技术[37]。
胃腸道類器官是指再現胃腸道結構的類器官。胃腸道起源於內胚層,在發育過程中形成一個管狀構造,可以分為三個不同的區域,與其他器官一起產生胃腸道的以下部分:[4]
胃腸道類器官又可細分為以下數種:
迄今为止,肠类器官[16]属于直接由肠组织或多能干细胞产生的肠道类器官[4]。促使人类多能干细胞形成肠类器官的方法是,首先使用激活素A驱動细胞进入中内胚层状态,然后对Wnt3a和Fgf4信号通路进行上调,因为它们已被证明可以促进組織走向后肠道細胞命运[4]。肠类器官也可以由肠干细胞产生,从成体组织中提取并在立體培养基中培养[30]。这些成体干细胞衍生的类器官通常被称为肠类器官或类结肠类器官,具体取决于它们的起源部分,并且是从人类和小鼠肠道中建立的[16][38][39]。肠类器官由围绕中央管腔的单层极化肠上皮细胞组成。因此,通过再現肠道的功能、生理学和组织,并维持结构中正常存在的所有细胞类型(包括肠干细胞),再現肠道的隐窝绒毛结构[4]。因此,肠类器官是研究肠道营养转运[40][41]、药物吸收和递送[42][43]、纳米材料和纳米医学[44][45]、肠泌素分泌[46][47]和各种肠道病原体感染[48][49]等議題的有力模型。
例如,王群团队利用肠类器官衍生的粘膜模型设计了人工病毒纳米顆粒作为口服药物递送载体(ODDV)[50],并展示了利用新建立的结肠类器官作为高通量药物筛选、毒性分析工具的新概念。测试和口服药物开发[51]。肠类器官还以如此高的保真度再现了隐窝绒毛结构,以至于它们已成功移植到小鼠肠道中,因此被高度视为有价值的研究模型[4]。肠类器官已被利用的研究领域之一是干细胞生态位。肠类器官被用来研究肠干细胞區位的性质,並证明了IL-22在维持肠干细胞中的重要作用[52]以及其他細胞類型(如神經元和成纖維細胞)在維持腸道幹細胞的重要性[30]。在感染生物学领域,人们已经探索各類基于肠道类器官的模型系统。一方面,只需将类器官与感兴趣的肠道病原体混合即可大量感染[53]。然而,为了模擬更接近自然情況下,由肠腔开始的感染途徑,需要使用病原体进行显微注射[54][55]。此外,肠类器官的极性可以反转[56],甚至可以解离成单个细胞并以二维单层培养[57][58],以便使上皮的顶端和基底外侧更容易接近。最後,肠类器官也显示出用於治疗的潜力[59]。

為了更準確地再現體內腸道,開發了腸道類器官和免疫細胞的共培養方式[58]。此外,器官晶片模型将肠道类器官与其他細胞或體內環境(例如内皮细胞、免疫细胞以及蠕动)结合起来[60][61]。
Remove ads
胃类器官部分地再現了胃的生理性質。通过在三维培养条件下对FGF、WNT、BMP、视黄酸和EGF信号通路进行时间尺度上的調控,可以從多能干细胞直接生成胃類器官[62]。胃类器官也可以由LGR5+的胃成体干细胞产生[63]。胃类器官已被用作研究癌症[64][65]以及其他人类疾病发育的模型[62]。例如,一项研究[65]调查了患者转移性肿瘤背后的潜在遗传變化,发现相較於同一患者身上的原发性肿瘤,转移性肿瘤的TGFBR2基因的两个等位基因均发生突变。为了进一步评估TGFBR2在转移中的作用,研究人员创建了TGFBR2基因敲落的类器官,透過这种类器官,他们证明TGFBR2活性降低会导致體內與體外環境下的惡性肿瘤侵袭與转移。
舌类器官是再現舌头生理学各方面的类器官。在立體培养条件下,透過EGF、WNT和TGF-β的調控,使用表达BMI1的上皮幹细胞培養出上皮舌类器官[66]。然而,这种类器官培养物缺乏味觉受体[66]。相較之下,含有味觉细胞的味蕾类器官則是使用LGR5+或CD44+的輪狀乳突幹細胞/前驅細胞[67]或者Lgr5+或LGR6+的味觉幹细胞创建的[68]。
- 细胞排斥性微量滴定板的最新进展使得能够快速、经济高效地筛选大分子药物(例如针对胰腺癌3D模型的库)。这些模型在表型和表达谱上与David Tuveson博士实验室发现的模型一致。
- 上皮类器官[16][80]
- 肺类器官[81]
- 肾类器官[17][82][83][84]
- 原肠胚(胚胎类器官)[85][86][87][88]——可以生成所有胚胎轴並且在前后轴的方向與Hox基因表达的形式共線[88]。
- 囊胚類器官[89][90][91]
- 子宫内膜类器官[92]
- 心脏类器官[93]——2018年,中空心脏类器官被提出,並表現心搏且可以對刺激產生反應而改變跳動速度[94]。
- 视网膜类器官[95][96]
- 乳腺癌类器官[97]
- 结直肠癌类器官[98]
- 胶质母细胞瘤类器官[99]
現今,來自患者的外植體(patient derived explants,PDX)或直接來自癌症組織的三維器官模型已經可以輕易製備,並且可將其用於現有核准藥物的高通量篩選。
由腦微血管內皮細胞(BMECs)、星形細胞和周細胞組成的自組裝細胞聚集體正逐漸成為物質穿膜和微流體模型的潛在替代方案。這些器官模型能夠生成血腦屏障(BBB)的許多特徵,如緊密連接的表達、分子運輸蛋白和藥物排出泵,因此可以用來模擬藥物穿越BBB的過程。此外,它們可以作為評估BBB與相鄰腦組織之間相互作用的模型,並提供了一個了解新藥物克服BBB的綜合能力以及其對腦組織的影響的平台。此類模型具有高度可擴展性,且比微流體裝置更容易製造和操作。然而,它們對於重建BBB的形態和生理學以及模擬生理流動和剪應力的能力有限[103]。
Remove ads
基礎研究
类器官能够協助研究细胞與細胞間、細胞與环境之間的相互作用以及疾病和藥物如何影響他們的作用。體外培养使该系统易于操作及监测。器官的實際體積過大使得物質滲透受到限制而不易培養,但类器官的小尺寸可以規避此问题。另一方面,類器官并不表现出所有器官特征,并且与其他器官的相互作用在体外也无法重现。虽然腸道類器官的第一個研究方向是用於探討幹细胞特性的调控[16],但如今也用于研究营养物质的摄取、药物转运和肠泌素的分泌等議題[104]。这对于吸收不良疾病以及肥胖、胰岛素抵抗和糖尿病等代谢疾病具有重要意义。
疾病模型
类器官提供建立人类疾病细胞模型的机会,可以在实验室中进行研究以更好地了解疾病的原因并确定可能的治疗方法。类器官在这方面的潛力首次在小头畸形的遗传研究中顯現,其中患者细胞被用来制造脑类器官,这种类器官较小并且在早期神经元生成中表现出异常[23]。另一个案例是将CRISPR应用于人类多能干细胞,在与两种不同肾脏疾病(多囊肾病和局灶节段性肾小球硬化症)相关的基因中引入靶向突变[83]。这些经过CRISPR修饰的多能干细胞随后被培养成人类肾类器官,表现出疾病特异性表型。来自患有多囊肾病突变的干细胞的肾脏类器官由肾小管形成了巨大的半透明囊肿结构。当在悬浮的情况下培养时,这些包囊的大小在數個月內达到直径1厘米[105]。与局灶节段性肾小球硬化症相关的基因发生突变的肾类器官,其足细胞(该疾病中受影响的过滤细胞)之间出现了細胞连接的缺陷[106]。重要的是,这些疾病表型在具有相同遗传背景但缺乏CRISPR突变的对照类器官中不存在[83][105][106]。将这些类器官表型与小鼠和人类的患病组织进行比较,发现它们与早期发育缺陷有相似之处[105][106]。
正如Takahashi和Yamanaka于2007年首次發表的那样,诱导多能干细胞(iPSC)也可以从患者皮肤纖維母细胞中重编程[107]。这些干细胞携带患者的确切遗传背景,包括可能导致人类疾病发展的任何基因突变。由于ORCL1突变而患有Lowe综合征的患者已将这些细胞分化为肾脏类器官[108]。该报告比较了患者iPSC与不相关的对照iPSC分化的肾类器官,并证明患者肾细胞无法调动高尔基体中的转录因子SIX2[108]。因为SIX2是肾單元前驅细胞的一个明确标记,作者得出结论為,洛氏综合征(近曲小管在吸收的整体衰竭或范康尼氏症候群)中常见的肾脏疾病可能与肾单元引起的改变有关,其中祖细胞缺乏这种重要的SIX2基因表达[108]。
其他研究使用CRISPR来修復患者iPSC细胞中的突变,以创建等位基因对照,该对照可以与iPSC重编程同时进行[109][110][111]。将患者iPSC衍生的类器官与同基因对照进行比较是该领域当前的黄金标准,因为它允许将感兴趣的突变分离为实验模型中的唯一变量[112]。在一份报告中,将源自IFT140复合杂合突变的Mainzer-Saldino综合征患者iPSC的肾类器官与等基因对照类器官进行比较,其中通过CRISPR修正了产生无活性mRNA转录物的IFT140突变体[110]。患者肾类器官表现出与现有动物模型一致的异常纤毛形态,在基因修正的类器官中将其恢复为野生型狀態[110]。比較患者和对照类器官中纯化的上皮细胞的转录組突显了涉及细胞极性、细胞-细胞连接和动力蛋白運動组装的途径,其中一些途径与肾纤毛病表型家族中的其他基因型有关[110]。另一份利用等基因对照的报告表明,先天性肾病综合征患者产生的肾脏类器官的肾小球中去氧肾上腺素定位异常[111]。
最後,諸如上皮代謝之類的事情也可以利用類似方式建模[113]。
個人化醫療
Clevers小組建立的方法可以從直腸活檢樣本中培養出的腸類器官,目前已被用於模擬囊腫性纖維化[114],並促使類器官首次運用於個人化醫療[115]。囊腫性纖維化是一種遺傳性疾病,由囊腫性纖維化穿膜傳導調節基因(Cystic fibrosis transmembrane conductance regulator,CFTR)的突變引起,該基因編碼位於健康上皮表面維持液體所需的離子通道。Jeffrey Beekman實驗室於2013年進行的研究描述,以毛喉素或霍亂毒素等cAMP升高激動劑刺激結直腸類器官,會以完全CFTR依賴性的方式誘導類器官快速腫脹[114]。非囊腫性纖維化患者的類器官因為液體輸送到類器官管腔而對毛喉素產生反應並膨脹,相較之下,來自囊腫性纖維化患者的類器官則嚴重減少或不存在。修復CFTR蛋白的療法可以恢復腫脹,這表明可以在臨床前實驗室環境中量化個體對CFTR調節療法的反應。2013年,Schwank等人於更進一步證明腸道囊腫性纖維化類器官的異常表型可以透過CRISPR-Cas9基因編輯進行修復[116]。
2016年,Dekkers等人的後續研究表明,來自囊腫性纖維化患者的腸道類器官之間由毛喉素誘導的腫脹程度差異與已知的診斷和預後標誌物(例如CFTR基因突變或CFTR功能的體內生物標記)相關[115]。此外,他們證明具有特定CFTR突變的腸道類器官接受CFTR調節劑處裡後的效果與已發表的臨床試驗結果相似。這促使臨床前研究發現來自具有極其罕見的CFTR突變且未經過治療的患者類器官對臨床使用的CFTR調節劑有強烈反應。這些臨床前類器官測試所得到的治療成效被後續Kors van der Ent所帶領的團隊執行的臨床試驗所證實。這些研究首次表明類器官可以應用於個人化醫療。
類器官移植
2022 年,類器官被首次用於移植手術。一名患有潰瘍性結腸炎的患者,藉由採集其健康結腸黏膜的細胞進行體外培養1個月後,將這些細胞生長而成的類器官重新移植回患者身上,取得良好的治療效果[117][118]。
作為發育生物學的模型
類器官為研究人員提供了研究發育生物學的模型[119]。自從多能幹細胞被提出後以來,利用二維培養在體外定向誘導多能幹細胞的分化已經取得了巨大的進展[119]。如今,多能性幹細胞培養的技術進步搭配3D培養技術的發展,使得培養各類器官內的特定細胞組織成為可能[119]。因此,這些類器官的使用極大地促進了我們對器官發生過程和發育生物學領域的理解[119]。例如,中樞神經系統的發育中,類器官的研究有助於科學家理解視神經盤形成過程中物理力量的扮演的角色[119][120]。近期的研究則專注於延長皮質類器官的生長週期並且取得顯著的進展。在一些研究中,類器官存在將近一年,並表現出人類胎兒發展階段的部分特徵[121]。
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
