Oxid sírový
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Oxid sírový (chemický vzorec SO3) je jeden z oxidů síry, který je hlavní příčinou vzniku kyselých dešťů. Vyrábí se ve velkém množství jako prekurzor kyseliny sírové.
Remove ads
Příprava a výroba
Průmyslově se vyrábí oxidací oxidu siřičitého
- Oxid siřičitý reaguje s kyslíkem za vzniku oxidu sírového.
Tato reakce je silně exotermická a je vratná; proto je nutno ji provádět za relativně nízkých teplot do 500 °C a za přítomnosti katalyzátorů (např. platiny nebo oxidu vanadičného, wolframového, molybdenového aj.). Za vysokých teplot vyšších než 800 °C probíhá tato reakce opačným směrem a z oxidu sírového vzniká opět oxid siřičitý a kyslík].
V laboratoři se oxid sírový připravuje rozkladem síranu železitého:
- Síran železitý se rozkládá na oxid železitý a oxid sírový.
nebo destilací olea, což je roztok oxidu sírového v kyselině sírové, případně zahříváním hydrogensíranu sodného
- dehydratace:
- Hydrogensíran sodný se rozkládá na disíran sodný a vodu.
- rozklad:
- Disíran sodný se rozkládá na síran sodný a oxid sírový.
Remove ads
Vlastnosti
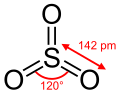
Struktura
V plynném stavu má monomerní forma oxidu planární uspořádání (grupa symetrie D3h). V kapalném i plynném skupenství existuje rovnováha mezi monomerem a trimerem (S3O9). V pevném stavu je oxid sírový vždy trimerní nebo polymerní. Cyklický trimer zaujímá vaničkovou konformaci (grupa symetrie D3v) podobnou cyklohexanu.
Krystaluje v podobě bezbarvých kosočtverečných krystalů jako modifikace γ-SO3; pokud přijde do styku s vodou, tak vytváří bílé jednoklonné jehličkovité krystaly modifikace β-SO3, které jsou tvořeny směsí vláknitých polysírových kyselin. Nejstálejší formou oxidu sírového je jednoklonný α-SO3, který má složitou vrstevnatou strukturu, vzniklou příčným spojováním řetězců.

Chemické vlastnosti
S vodou reaguje velmi prudce, a podle stechiometrického poměru reakčních složek vzniká buď kyselina sírová
nebo oleum, případně směsi polysírových kyselin. Oxid sírový je velmi silné dehydratační činidlo: z organických látek odštěpuje vodu, např. jeho působením na ethanol vzniká ethen (ethylen) a kyselina sírová
Reakci s halogenovodíky vznikají halogensírové kyseliny HSO3X, např. reakcí s chlorovodíkem
vzniká kyselina chlorsírová (chlorsulfonová).
Oxid sírový je velmi silnou Lewisovou kyselinou. Tvoří proto velké množství různých aduktů s mnoha organickými i anorganickými ligandy.
Remove ads
Použití
Průmyslově vyráběný oxid sírový se ihned zpracovává na kyselinu sírovou.
Bezpečnost
Oxid sírový je silně žíravý, neboť ve styku s tkáněmi těla z nich odnímá vodu a mění se na kyselinu sírovou. Necháme-li odpadnout kapku vody na oxid sírový, dojde k explozívní reakci.
Reference
Literatura
Externí odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads