Top-Fragen
Zeitleiste
Chat
Kontext
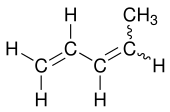
1,3-Pentadien
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
1,3-Pentadien ist eine unpräzise Bezeichnung für zwei chemische Verbindungen aus der Gruppe der Diene, die zueinander isomer (Konfigurationsisomere) sind. Sie werden meist cis- bzw. trans-1,3-Pentadien genannt. Das Isomerengemisch wird auch als Piperylen (abgeleitet von Piperin[4][5]) bezeichnet. Ein Konstitutionsisomer der 1,3-Pentadiene ist der verzweigte Kohlenwasserstoff 2-Methylbutadien (Isopren).
Remove ads
Geschichte
August Wilhelm Hofmann ließ 1-Methylpiperidin mit Methyliodid zum quartären Ammoniumiodid reagieren und führte die später nach ihm benannte Abbau-Reaktion durch, die Hofmann-Eliminierung. Das gebildete N,N-Dimethylpent-4-enylamin wurde nochmals diesem Abbau unterworfen. Der nach zweimaliger Eliminierung entstehende ungesättigte Kohlenwasserstoff wurde von Hofmann vorläufig als Piperylen bezeichnet; der Name blieb aber noch lange in Gebrauch.[4] Bei der Eliminierung von Trimethylamin aus dem N,N-Dimethylpent-4-enylamin entsteht zunächst 1,4-Pentadien, das aber unter den Reaktionsbedingungen zum 1,3-Pentadien isomeriert.[6]

Remove ads
Vorkommen

1,3-Pentadien kommt natürlich im Öl der Pelargonium graveolens vor.[7]
Isomere
| Isomere von 1,3-Pentadien | |||||||
| Name | trans-1,3-Pentadien | cis-1,3-Pentadien | |||||
| Andere Namen | trans-Penta-1,3-dien (E)-1,3-Pentadien trans-Piperylen (E)-Piperylen |
cis-Penta-1,3-dien (Z)-1,3-Pentadien cis-Piperylen (Z)-Piperylen | |||||
| Strukturformel |  |  | |||||
| CAS-Nummer | 2004-70-8 | 1574-41-0 | |||||
| 504-60-9 (Isomerengemisch) | |||||||
| EG-Nummer | 217-909-5 | 216-401-0 | |||||
| 207-995-2 (unspez.) | |||||||
| ECHA-Infocard | 100.016.282 | 100.014.911 | |||||
| 100.007.269 (unspez.) | |||||||
| PubChem | 62204 | 643785 | |||||
| – (unspez.) | |||||||
| Wikidata | Q126292 | Q27286734 | |||||
| Q72499706 (unspez.) | |||||||
| Schmelzpunkt | −87 °C[8] | −141 °C[9] | |||||
| Siedepunkt | 42 °C[8] | 44 °C[9] | |||||
| Dichte | 0,683 g·cm−3 (25 °C)[8] | 0,691 g·cm−3 (25 °C)[9] | |||||
| Dampfdruck | 452 hPa (20 °C)[8] | 453 hPa (20 °C)[9] | |||||
| Standardbildungsenthalpie | = +18,11 ± 0,16 kcal/mol[10] | = +19,77 ± 0,22 kcal/mol[10] | |||||
| Brechungsindex | 1,430 (20 °C)[8] | 1,437 (20 °C)[9] | |||||
| GHS- Kennzeichnung |
|
| |||||
| H- und P-Sätze | 225‐304‐315‐319‐335 | 225‐304 | |||||
| keine EUH-Sätze | keine EUH-Sätze | ||||||
| 210‐261‐301+310‐305+351+338‐331 | 210‐301+310‐331 | ||||||
Gewinnung und Darstellung
1,3-Pentadien kann durch eine Wittig-Reaktion aus Acetaldehyd, Acrolein oder Crotonaldehyd hergestellt werden, wobei sowohl die Ausbeute als auch die cis/trans-Selektivität in Abhängigkeit von verschiedenen Faktoren (z. B. dem Ausgangsstoff oder dem verwendeten Lösungsmittel) variiert.[11]
Industriell entsteht es als Nebenprodukt des Trennprozesses von rohen C5-Materialien von Pyrolysebenzin (Pygas) – beide Nebenprodukte der Herstellung von Ethylen.[12]
Die Herstellung kann auch durch Methylierung von 1,3-Butadien mit Dimethylsulfoxid in Gegenwart einer Base wie Kalium-tert-butoxid erfolgen, wobei ein Gemisch aus etwa 80 % trans- und 20 % cis-1,3-Pentadien entsteht.[2] Chemiker der Esso Research and Engineering Company in Linden, New Jersey (USA) berichteten über die Methylierung von 1,3-Butadien und anderen ungesättigten Kohlenwasserstoffen mittels Dimethylsulfoxid. Letzteres wird durch starke Basen deprotoniert, wobei das Dimsylat-Anion entsteht. Dieses wird an das konjugierte Dien addiert.[13][14]

Remove ads
Eigenschaften
Zusammenfassung
Kontext
Physikalische Eigenschaften
1,3-Pentadien ist eine farblose Flüssigkeit mit Siedepunkt 42–44 °C.[8] Untersuchungen zur Thermodynamik von Pentadienen in der Gasphase ergaben, dass die molaren Bildungsenthalpien von cis- und trans-1,3-Pentadien sich um 6,95 kJ/mol unterscheiden. Danach ist das trans-Isomer etwas stabiler.[10]
Chemische Eigenschaften
Beim Erhitzen von cis-1,3-Pentadien auf ca. 250 °C kann ein Wasserstoffatom der Methylgruppe mit der terminalen Methylidengruppe verknüpft werden. Es handelt sich um ein chemisches Gleichgewicht, das thermische 1,5-Wasserstoffverschiebung, kurz 1,5-H-Verschiebung (engl. 1,5-H-Shift) genannt wird.[15] In diesem Fall ließ es sich nur durch Markierung des Pentadiens mit Deuteriumisotopen nachweisen.[16] Die Reaktion wurde von Robert Burns Woodward und Roald Hoffmann als 1,5-sigmatrope Verschiebung klassifiziert, welche konzertiert und suprafacial erfolgt.[17] Verschiedene quantenchemische Berechnungen haben sich mit dieser Reaktion befasst.[18][19] (Anmerkung: Die o. g. Isomerisierung von 1,4-Pentadien zu 1,3-Pentadien wäre als suprafaciale 1,3-H-Umlagerung konzertiert nicht möglich; offenbar ist diese Reaktion basenkatalysiert).


1,3-Pentadien reagiert mit molekularem Brom zu diastereomeren 1,2,3,4-Tetrabrompentanen. Diese Tetrabromide spielten schon bei A. W. Hofmanns Konstitutionsbestimmung (s. o.) eine Rolle, um nachzuweisen, dass die Verbindung zwei C=C-Doppelbindungen enthält.
Die wichtigste Reaktion des 1,3-Pentadiens dürfte die Polymerisation zu Polypentadienen sein. Wie beim Polybutadien können die Verknüpfungen des Monomers in 1,2- und 1,4-Position („1,2-Addition“ bzw. „1,4-Addition“) stattfinden. Mit Butyllithium initiiert ist eine anionische Kettenpolymerisation möglich.[20]
In Anlehnung an die im Ziegler-Natta-Verfahren verwendeten Katalysatoren wurden mit Cobalt-haltigen Organoaluminium-Verbindungen, die z. B. aus Diethylaluminiumchlorid (AlEt2Cl), oder Triethyl-dialuminiumtrichlorid (Al2Et3Cl3) hergestellt wurden, Katalysatoren entwickelt, mit denen Polymere verschiedener Struktur und Eigenschaften erhalten werden. Kristalline Polymere bestehen aus cis-1,4-syndiotaktischen Strukturelementen, amorphe Polymere sind aus cis-1,4- und 1,2-Einheiten zusammengesetzt. Schwach kristalline Polymere haben eine 1,2-syndiotaktische Struktur.[21] Mit einem ähnlichen Cobalt-Katalysator wurde trans-1,2-Poly-1,3-pentadien hergestellt.[22]
Remove ads
Verwendung
1,3-Pentadien, b. z. w. Piperylen dient in erster Linie als Monomer bei der Herstellung von Kunststoffen, Klebstoffen und Harzen. Piperylen-basierte Produkte werden insbesondere in modernen Klebstoffen – wie bei der Herstellung von Briefumschlägen, Paketband und Windelbefestigungen – sowie weltweit in Fahrbahnmarkierungen verwendet. Außerdem wird 1,3-Pentadien zur Herstellung anderer chemischer Verbindungen wie z. B. 2-Methylfuran verwendet.[12]
Remove ads
Literatur
- Arno Behr, Peter Neubert: Piperylene — A Versatile Basic Chemical in Catalysis. In: ChemCatChem, 6, 2013, S. 1867–3880. doi:10.1002/cctc.201300523.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads