Top-Fragen
Zeitleiste
Chat
Kontext
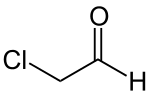
Chloracetaldehyd
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Chloracetaldehyd ist eine chemische Verbindung aus der Gruppe der Aldehyde. Er ist neben dem Dichloracetaldehyd und Trichloracetaldehyd einer der drei möglichen chlorierten Acetaldehyde. Die Verbindung bildet ein relativ stabiles Aldehydhydrat ClCH2CH(OH)2.
Remove ads
Darstellung und Gewinnung
Beim Wacker-Hoechst-Verfahren zur Herstellung von Acetaldehyd aus Ethen fällt Chloracetaldehyd als Nebenprodukt an.[6] Wasserfreier Chloracetaldehyd kann durch die Oxidation von α-Chlorhydrin mittels Periodat erhalten werden.[3][7] Ebenfalls kann der Aldehyd auch in guter Ausbeute durch die Pyrolyse von Chlorethylencarbonat gewonnen werden.[6][8]

Eine gezielte Synthese durch die α-Chlorierung von Acetaldehyd ist ebenfalls bekannt.
Remove ads
Eigenschaften
Zusammenfassung
Kontext
Chloracetaldehyd ist eine farblose, stechend riechende Flüssigkeit, die unter Normaldruck bei 85 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 7,26359, B = 1338,8586 und C = 220,432 im Temperaturbereich von −7 bis 107 °C.[9] Die kritischen Größen lauten für die kritische Temperatur 282 °C, für den kritischen Druck 53,7 bar, für das kritische Volumen 0,201 l·mol−1 und für die kritische Dichte 0,3905 g·cm−3.[10] Die Verbindung ist in Wasser unter Hydratbildung sowie in üblichen organischen Lösungsmitteln gut löslich.[2] In Wasser wird ein auch als Hemihydrat bezeichnetes dimeres Acetal, chemisch 1,1'-Dihydroxy-2,2'-dichlordiethylether gebildet.[6] Diese Verbindung bildet farblose Kristalle, die zwischen 43 und 50 °C schmelzen und bei 84 °C scheinbar sieden, wobei der Zerfall in den Ausgangsaldehyd und Wasser erfolgt.[6]

Die Löslichkeit in Wasser ist durch den Gehalt an der Hemihydratverbindung bestimmt.[6]
Löslichkeit des Hemihydrats in Wasser[6] Temperatur in °C 1 10 20 30 40 Konzentration in Ma% 13,35 22,2 44,3 62,7 81,5
Die Hemihydratverbindung lässt sich in Gegenwart von konzentrierter Schwefelsäure zum Trichlorparaldehyd (2,4,6-Trichlormethyl-1,3,5-trioxan), dem Trimeren des Chloracetaldehyds, zyklisieren.[6][11] Das Trimer bildet farblose Kristalle, die bei 88–89 °C schmelzen.[6]

Durch eine azeotrope Dehydratisierung kann aus der Hemihydratverbindung das Tetramer Tetrachlormetaldehyd (2,4,6,8-Tetrakis(chlormethyl)-1,3,5,7-tetroxocan) erhalten werden.[12][6] Die Verbindung bildet farblose Kristalle, die bei 65–67 °C schmelzen bzw. sich bei einem Druck von 1,3 Pa bei 127–130 °C verdampfen lassen.[6]

Die wasserfreien Verbindung neigt bei der Lagerung bei Raumtemperatur zur Bildung von Trimeren, Tetrameren und Polymeren mit einer Polyoxymethylenstruktur.[6]
Chloracetaldehyd bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Mit einem Flammpunkt von 70 °C gilt die Substanz als schwer entflammbar.[1] Der Explosionsbereich liegt zwischen 3,9 Vol.‑% als untere Explosionsgrenze (UEG) und 9,0 Vol.‑% als obere Explosionsgrenze (OEG).[1]
Remove ads
Toxikologie und Arbeitsschutz
Der Kontakt mit der Verbindung in flüssiger oder dampfförmiger Form kann zu einer zu starken Reizung bis zu einer Verätzung der Augen, der Atemwege und der Haut führen. Die Bildung eines Lungenödems kann nicht ausgeschlossen werden. Der LD50-Wert (Ratte, oral) beträgt 75 mg·kg−1.[2]
Verwendung
Chloracetaldehyd wird als vielseitiges Start- oder Zwischenprodukt in der organischen Synthese verwendet.[3] In der Synthese von Heterocyclen wie z. B. für Pyrrole[13], Furane[14][15][16], Thiophene[17][18], Imidazole[19][20], Oxazoline[21], Thiazoline[22], Thiazole[23][24] oder Indole[25] ist die Verbindung eine wichtige Ausgangssubstanz. Chloracetaldehyd kommt als Rohstoff für die Herstellung von Arzneimitteln, Insektiziden, Fungiziden, Desinfektionsmitteln, Farbstoffen, Härtern von Epoxidharzen und Antistatika zum Einsatz.[2]
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads