Top-Fragen
Zeitleiste
Chat
Kontext
Fibrillin
Proteinfamilie Aus Wikipedia, der freien Enzyklopädie
Remove ads
Fibrillin ist ein für die Bildung elastischer Fasern essenzielles Glykoprotein, das im Bindegewebe vorkommt.[1] Fibrillin wird von Fibroblasten in die extrazelluläre Matrix sezerniert. Aus ihnen entstehen Mikrofibrillen, die als Gerüststruktur für die Einlagerung von Elastin dienen.[2]
Remove ads
Eigenschaften
Die Kontrolle der Bioverfügbarkeit des Wachstumsfaktors TGF-β ist wichtig für die Gewebebildung und der Homöostase. Die Ablagerung des latenten TGF-β-Komplexes (LLC) in der extrazellulären Matrix wird durch Fibrillin-Mikrofibrillen verursacht. Dabei interagiert das in dem Komplex befindliche Protein LTBP-1 (Latent TGFβ-binding protein 1) mit Fibronektin während der Fibrillogenese.[3] Außerdem beteiligen sich Fibrilline an der strukturellen Erhaltung der extrazellulären Matrix, indem sie sich an BMP7-ähnlichen Wachstumsfaktoren binden.[4]
Remove ads
Klinische Bedeutung
Mutationen in FBN1 und FBN2 stehen im Zusammenhang mit Skoliose.[5]
Arten
Zusammenfassung
Kontext
Fibrillin-1
Fibrillin-1 ist der Hauptbestandteil der Mikrofibrillen, die im Falle der elastischen Fasern wie ein Mantel den amorphen Kern aus Elastin umgeben. Bisher wurden vier Formen von Fibrillinen beschrieben. Fibrillin-1 wurde durch Engvall 1986 isoliert,[6] und Mutationen im FBN1-Gen sind für das Marfan-Syndrom verantwortlich.[7][8]
Das Protein kommt im Menschen vor und sein Gen befindet sich auf Chromosom 15. Bisher wurden mehr als 1500 verschiedene Mutationen beschrieben.
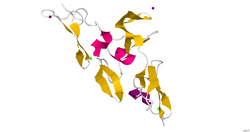
Struktur
Bisher gibt es keine vollständige, hochaufgelöste Struktur von Fibrillin-1. Es wurden jedoch kürzere Fragmente rekombinant hergestellt und ihre Strukturen mit Röntgenkristallographie bzw. NMR-Spektroskopie aufgeklärt. Ein neueres Beispiel ist die Struktur der Fibrillin-1-Hybrid-Domäne in Bezug auf die kalziumbindende epidermale Wachstumsfaktordomäne. Diese wurde mittels Röntgenkristallographie und einer Auflösung von 1,8 Å bestimmt. Die Mikrofibillen, die aus Fibrillinproteinen bestehen, sind bedeutsam für unterschiedliche Interaktionen zwischen Zellen und der extrazellulären Matrix.
Fibrillin-2
Fibrillin-2 wurde erstmals 1994 von Zhang[9] isoliert. Es wird vermutet, dass es eine wesentliche Rolle in der frühen Phase der Elastogenese (Bildung elastischer Fasern) spielt. Mutationen im Fibrillin-2-Gen wurden mit dem Beals-Hecht-Syndrom in Verbindung gebracht.
Fibrillin-3
Für Fibrillin-3 wird angenommen, dass es hauptsächlich im Gehirn vorkommt.[10] Es wurde außerdem für die Feldmaus gezeigt, dass Fibrillin-3 in den Eierstöcken und in der Keimdrüse vorkommt.
Fibrillin-4
Fibrillin-4 wurde erstmals im Zebrabärbling entdeckt, seine Sequenz ähnelt sehr der des Fibillin-2.[11]
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads