Top-Fragen
Zeitleiste
Chat
Kontext
Kolbe-Elektrolyse
Elektrolyse von Carbonsäuren Aus Wikipedia, der freien Enzyklopädie
Remove ads
Die Kolbe-Elektrolyse ist eine chemische Reaktion, bei der durch Elektrolyse von Carbonsäuren oder ihren Salzen, den Carboxylaten, zwei Reste aneinander gekuppelt werden. Benannt wurde die Kolbe-Elektrolyse nach ihrem Entdecker Hermann Kolbe (1818–1884).[1][2] Er stellte auf diese Weise beispielsweise Ethan aus Essigsäure dar (R = H):

Reaktionsmechanismus
Zusammenfassung
Kontext
Das Salz der Carbonsäure (Carboxylanion) wird an der Anode zum Carboxylat-Radikal oxidiert. Dieses Radikal spaltet Kohlenstoffdioxid ab, wobei wieder ein Radikal entsteht. Jeweils zwei dieser Radikale verbinden sich (dimerisieren) dann zum Alkan:[3]
An der Kathode entsteht gleichzeitig Wasserstoff:
Wird Gleichspannung angelegt, wandern die positiv geladenen Metall-Kationen zur Kathode (dem Minuspol) und die negativ geladenen Carboxylate zur Anode, wo sie reagieren. Als Gegenionen zum Carboxylat werden meist Alkali- oder Alkylammonium-Kationen verwendet, da diese die Reaktion nicht beeinflussen. Andere Metallionen wie Fe2+, Mn2+ und Co2+ reduzieren die Ausbeute.
Remove ads
Ausbeute
Für symmetrische n-Alkane kann eine Ausbeute von bis zu 90 % erreicht werden, abhängig von Parametern wie Stromdichte, Lösungsmittel, Salzkonzentration und Temperatur. Werden verschiedene Carboxylate eingesetzt (gemischte Kolbe-Elektrolyse), sind auch Produkte mit ungeradzahliger Anzahl von Kohlenstoff-Atomen zugänglich. Die Ausbeuten sinken jedoch, da meist Produktgemische entstehen:
- 3 R1COO− + 3 R2COO− → R1–R1 + R1–R2 + R2–R2 + 6 CO2 + 6 e−
Als Anodenmaterial hat sich Platin bewährt.
Die Ausbeuten der Reaktion hängen von verschiedenen Faktoren wie dem Substrat, den Elektrolysebedingungen, den Stromdichten und den eingesetzten Lösungsmitteln ab. Die Reaktion wird normalerweise bei moderaten Temperaturen durchgeführt.[4]
Remove ads
Beispiel
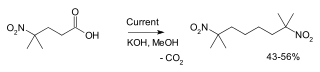
Eine Beispielreaktion ist die Synthese von 2,7-Dimethyl-2,7-dinitrooctan aus 4-Methyl-4-nitrovalerian(nitropentan)säure in Methanol an Platinelektroden:[5]
Historisches
Michael Faraday hatte schon 1834 berichtet, dass bei der Elektrolyse von Kaliumacetat ein Kohlenwasserstoff entstehen kann, den er aber nicht näher untersuchte.[6] 1848 berichtete Hermann Kolbe über die Elektrolyse der Valeriansäure (Pentansäure),[1] und der Buttersäure (Butansäure), wobei er die Kettenlänge der gebildeten Kohlenwasserstoffe richtig erkannt hatte. 1849 beschrieb er diese Reaktionen sowie die der Essigsäure genauer,[2] so dass er als Entdecker dieser C-C-verknüpfenden Elektrolyse gilt.
Remove ads
Literatur
- Hans J. Schäfer: CC-Verknüpfungen an Anode und Kathode. In: Angewandte Chemie. Band 93, Nr. 11. WILEY-VCH, November 1981, S. 978–1000, doi:10.1002/ange.19810931107.
- Thomas Laue, Andreas Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Studienbücher Chemie. Hrsg.: Ch. Elschenbroich, F. Hensel, H. Hopf. 5. Auflage. B. G. Teubner, GWV, Wiesbaden 2006, ISBN 3-8351-0091-2, S. 209–211.
- Barry M. Trost, Ian Fleming: Comprehensive organic synthesis : selectivity, strategy, and efficiency in modern organic chemistry. 1. Auflage. Pergamon Press, Oxford, England 1991, S. 633–658 (knovel.com).
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads