Top-Fragen
Zeitleiste
Chat
Kontext
Strecker-Abbau
Aus Wikipedia, der freien Enzyklopädie
Remove ads
Der Strecker-Abbau ist eine Namensreaktion der organischen Chemie, welche nach dem deutschen Chemiker Adolph Strecker benannt wurde. Die Reaktion beschreibt den irreversiblen, oxidativen Abbau von α-Aminosäuren mit α-Dicarbonylverbindungen zu Aldehyden oder Ketonen, welche um ein Kohlenstoffatom verkürzt sind. In der 1862 erschienenen Originalpublikation von Strecker wurde Alloxan als Oxidationsmittel genutzt und mit Alanin, Leucin sowie Glycin umgesetzt.[1]

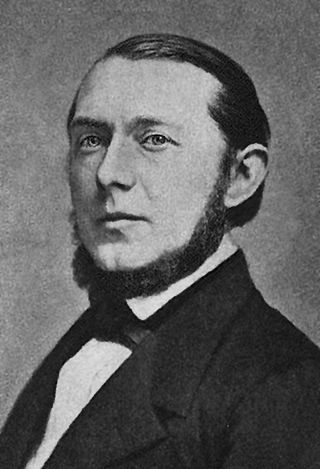
(* 21. Oktober 1822 in Darmstadt; † 7. November 1871)
Wie später beobachtet wurde, kann die Reaktion katalytisch oder nicht katalytisch erfolgen, wobei den nicht katalysierten Oxidationsreaktionen eine höhere Bedeutung zukommt.[2] Zudem können letztere mit einer Vielzahl organischer oder anorganischer Oxidationsmittel durchgeführt werden. Zu den organischen Oxidationsmitteln zählen z. B. Ketone, Aldehyde oder Peroxycarbonsäuren, während Ozon oder Wasserstoffperoxid in Anwesenheit von Silberoxid oder Eisen(II)-sulfat als anorganische Oxidationsmittel fungieren können.[3]
Remove ads
Reaktionsmechanismus


Mechanistisch erfolgt gemäß vielen Autoren (z. B. Zerong Wang) dabei zunächst die Bildung eines Imins, welches durch die nucleophile Reaktion der Aminogruppe aus der α-Aminosäure mit α-Dicarbonylverbindungen gebildet wird.[5] Anschließend erfolgt eine Decarboxylierung und Hydrolyse des Imins, wobei das um ein Kohlenstoffatom verkürzte Strecker-Aldehyd bzw. Strecker-Keton und Kohlenstoffdioxid gebildet werden.[6] Als Nebenprodukte entstehen Enaminole, welche Folgereaktionen zu Derivaten von Pyridinen, Pyrazinen oder Imidazolen eingehen können.[7] Die Reaktion läuft bei geringeren pH-Werten schneller ab, weil die Carboxylatgruppe schneller protoniert und Kohlenstoffdioxid darum schneller eliminiert werden kann.[2]
Remove ads
Praktische Bedeutung
Der Strecker-Abbau ist auch ein Teilschritt in der Maillard-Reaktion. Die aus der Reaktion hervorgehenden Aldehyde bilden flüchtige Aromakomponenten in Lebensmitteln. Besonders wichtig hierfür ist der Abbau schwefelhaltiger Aminosäuren (z. B. Cystin, Cystein, Methionin), da dabei schwefelhaltige Aldehyde wie Methional entstehen.[7] Die Bindung zwischen den Kohlenstoff- und Schwefelatomen dieser Produkte ist reduktiv leicht zu Schwefelwasserstoff, Alkylmercaptanen, Disulfiden und weiteren Verbindungen spaltbar. In hoher Verdünnung tragen diese zum Aroma vieler Lebensmittel bei (z. B. Zwiebeln, Tomaten, Kartoffeln, Pilze, Fleisch, Brot, Kaffee usw.). Die Entwicklung von Kohlenstoffdioxid während der Maillard-Reaktion wird auf Strecker-Abbau zurückgeführt.[6] Auch für biochemische Prozesse wie z. B. die Entstehung des Lichtgeschmacks von Milch wird die Reaktion verantwortlich gemacht. Darüber hinaus kann die Reaktion zur Synthese von Aldehyden, Ketonen oder α-Aminoketonen verwendet werden.[2]
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads