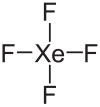Top-Fragen
Zeitleiste
Chat
Kontext
Xenontetrafluorid
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Xenontetrafluorid ist eine der wenigen Edelgasverbindungen und eine der zuerst (1962) entdeckten aus zwei Elementen.
Remove ads
Gewinnung und Darstellung
Zusammenfassung
Kontext
Xenontetrafluorid kann durch Reaktion der Elemente Xenon und Fluor bei 400 °C und 6 bar dargestellt werden. Das Verhältnis der Elemente muss 1:5 (Xenon:Fluor) betragen.[5][2] Alternativ kann es auch durch Reaktion von Xenon mit Sauerstoffdifluorid dargestellt werden.
Die Standardbildungsenthalpie der exothermen Reaktion beträgt .[5] Die Verbindung lässt sich auch durch die Fluorierung von Xenondifluorid gewinnen.[6]
Hier beträgt die Reaktionsenthalpie .
Remove ads
Eigenschaften
Zusammenfassung
Kontext

Physikalische Eigenschaften
Bei Normaldruck und einer Temperatur von 115,75 °C geht es durch Sublimation direkt vom festen in den gasförmigen Zustand über.[1] Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 117,10 °C[1][7] und einem Druck von 1,082 bar.[7] Die Sublimationsdruckfunktion ergibt sich entsprechend log10(P) = −A/T−B·log10(T)+C (P in Torr, T in K) mit A = 3226,27, B = 0,43434 und C = 12,301738 im Temperaturbereich von 275 bis 390 K.[7] Hier ergibt sich mittels einer Auswertung nach Clausius-Clapeyron eine Sublimationsenthalpie von 60,6 kJ·mol−1.[7] Die kritische Temperatur beträgt 339 °C, der kritische Druck 70,4 bar, die kritische Dichte 1,10 g·cm−3 und das kritische Volumen 189 cm3·mol−1.[8] Der Xenon-Fluor-Abstand beträgt im gasförmigen Zustand 194 pm, im Kristall 195,3 pm.[9]
Chemische Eigenschaften
Xenontetrafluorid ist unter normalen Bedingungen stabil, hydrolysiert aber bei Kontakt mit Wasser zu Xenontrioxid.
Die Verbindung ist ein starkes Oxidationsmittel. So wird metallisches Platin zu Platin(IV)-fluorid und metallisches Quecksilber zu Quecksilber(I)-fluorid oxidiert.[6] Durch Wasserstoff wird es zu Xenon und Fluorwasserstoff reduziert.[6]
Es reagiert heftig mit organischen Ethern wie Tetrahydrofuran und Dioxan.[6] Bei Kontakt mit brennbaren Stoffen, wie Aceton oder Leichtmetallpulver, kann die Verbindung explosionsartig reagieren.[10] Im Vergleich zu Xenondifluorid und Xenonhexafluorid bildet XeF4 nur schwer Salze, da das Kation XeF3+ mit zwei freien Elektronenpaaren und drei Bindungen eine ungünstige Elektronenkonfiguration besitzt.[11]
Molekülgeometrie
Gemäß dem VSEPR-Modell besitzt das Xenontetrafluorid-Molekül eine quadratisch-planare Struktur. Im gasförmigen Zustand beträgt die Bindungslänge 194 pm (1,94 Å) bzw. im Kristall 195,3 pm (1,953 Å).[11]
Xenondifluorid besitzt als Molekülsymmetrie die Punktgruppe D4h.[11] Um die Oktettregel zu erfüllen, besitzt das Xenontetrafluorid-Molekül noch zwei freie Elektronenpaare am Xenon.
Remove ads
Verwendung
Durch Lösen mit Antimonpentafluorid SbF5 in Flusssäure HF kann Xenontrifluoridohexafluoroantimonat(V) gewonnen werden.[12]
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads