Top-Fragen
Zeitleiste
Chat
Kontext
Clausius-Clapeyron-Gleichung
Funktional des Siedepunkts eines Reinstoffes Aus Wikipedia, der freien Enzyklopädie
Remove ads
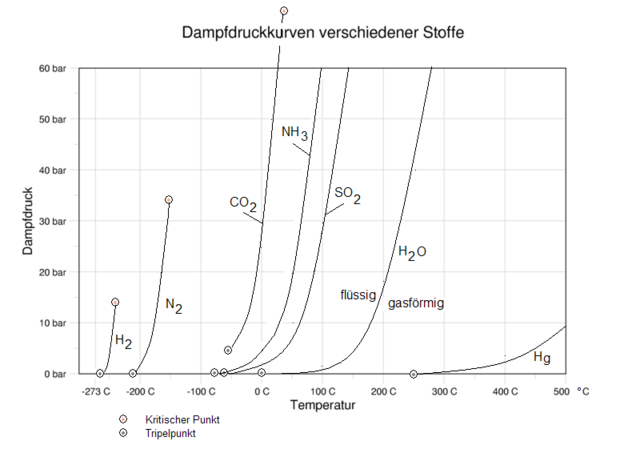
Die Clausius-Clapeyron-Gleichung wurde 1834 von Émile Clapeyron entwickelt und später von Rudolf Clausius aus den Theorien der Thermodynamik abgeleitet. Sie ist eine Spezialform der Clapeyron-Gleichung (Herleitung dort). Über die Clausius-Clapeyron-Gleichung lässt sich der Verlauf der Siedepunktskurve errechnen, d. h. der Phasengrenzlinie eines Phasendiagramms zwischen der flüssigen und der gasförmigen Phase eines Stoffes.

Remove ads
Thermodynamisch korrekte Gleichung
Zusammenfassung
Kontext
Die thermodynamisch korrekte Version der Gleichung ist
mit
- – Dampfdruck,
- – absolute Temperatur (in K),
- – molare Verdampfungsenthalpie (Index für Verdampfung bzw. englisch vapor ‚Dampf‘) und
- – Änderung des molaren Volumens zwischen gasförmiger und flüssiger Phase.
Remove ads
Approximation im Falle eines idealen Gases
Zusammenfassung
Kontext
Im Regelfall bezeichnet man als Clausius-Clapeyron-Gleichung die näherungsweise gültige Gleichung
- ,
mit der universellen Gaskonstante .
Diese Beziehung leitet sich wie folgt her. Da bei den meisten Verwendungszwecken das molare Volumen des Gases deutlich größer ist als das der Flüssigkeit
- ,
wurde gegenüber der thermodynamisch korrekten Gleichung die Volumendifferenz durch das molare Volumen des Gases ausgedrückt
- .
Außerdem wurde für die gasförmige Phase ein ideales Gas angenommen, für welches die Zustandsgleichung
gilt.
Remove ads
Integrierte Form
Zusammenfassung
Kontext
Betrachtet man die Verdampfungsenthalpie eines Stoffes als konstant über einen kleinen Temperaturbereich ( bis ), so kann die Clausius-Clapeyron-Gleichung über diesen Temperaturbereich integriert werden. Dann gilt
mit
- dem bekannten Sättigungsdampfdruck und der Temperatur des Ausgangszustands,
- dem Druck und der Temperatur des zu berechnenden Zustands.
Remove ads
Praktische Bedeutung
Zusammenfassung
Kontext
Chemie und Verfahrenstechnik
Für Flüssigkeits-Gas-Übergänge mit den oben beschriebenen Näherungen kann der Ausdruck wie folgt umgeschrieben werden:
- ,
wobei der Reaktor- bzw. Behälterdruck, die Gaskonstante, die absolute Temperatur und eine Konstante ist. steht für die molare Verdampfungsenthalpie. Die Kenntnis eines Punktes auf der Siedepunktskurve, zum Beispiel (1 bar, 373 K) für Wasser, bestimmt den Rest der Kurve. Umgekehrt ist die Beziehung zwischen und linear, so dass eine lineare Regression zur Schätzung der Verdampfungsenthalpie verwendet werden kann.
So berechnet sich für das Feuerzeug-Gas n-Butan bei Kenntnis der molaren Verdampfungsenthalpie an dessen Siedepunkt unter Atmosphärendruck (−0,5 °C, 1 bar) der notwendige Druck zur Kondensation bei 25 °C zu
- .
Dieser Druck würde somit in einem ausschließlich mit n-Butan befüllten Gasfeuerzeug herrschen. Da Isobutan und Propan niedrigere Siedepunkte als n-Butan aufweisen, werden diese Gase jedoch zugemischt, um einen Gebrauch auch bei Minustemperaturen und niedrigeren Meereshöhen (d. h. größeren Atmosphärendrücken) zu ermöglichen.
Meteorologie und Klimatologie
Pro Grad Erwärmung (z. B. bei einer Steigerung von 14 °C auf 15 °C[1]) kann Luft bzw. die Erdatmosphäre rund 7 Prozent mehr Feuchtigkeit in Form gasförmig gelösten Wassers („Wasserdampf“) aufnehmen (Sättigungsdampfdruck) – womit als Folge der globalen Erwärmung die Zunahme von Extremwetterereignissen mit erklärt werden kann.[2][3]
- (mit berechneter molarer Verdampfungsenthalpie für Wasser bei 14,5 °C)
Remove ads
Literatur
- M. K. Yau, R. R. Rogers: Short Course in Cloud Physics. 3. Auflage. Butterworth-Heinemann, 1989, ISBN 0-7506-3215-1 (englisch, 304 Seiten).
- Gerd Wedler: Lehrbuch der Physikalischen Chemie. Fünfte, vollständig überarbeitete und aktualisierte Auflage. Wiley-VCH, 2004, ISBN 3-527-31066-5 (1102 Seiten).
Weblinks
- Video: Dampfdruck von reinen Stoffen nach Clausius-Clapeyron – Wie wohl fühlt sich eine Komponente in einer Phase?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15670.
- Clausius-Clapeyron-Gleichung. In: Spektrum.de - Lexikon der Physik. Spektrum der Wissenschaft Verlagsgesellschaft mbH, Heidelberg, 1998, abgerufen am 22. Juni 2024.
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
























![{\displaystyle p_{\mathrm {n{\text{-}}Butan} }(25\,^{\circ }{\text{C}})=1\,\mathrm {bar} \cdot \exp \left[{\frac {22400\,{\frac {\mathrm {J} }{\mathrm {mol} }}}{8{,}314\,{\frac {\mathrm {J} }{\mathrm {mol} \cdot \mathrm {K} }}}}\cdot \left({\frac {1}{272{,}65\,\mathrm {K} }}-{\frac {1}{298{,}15\,\mathrm {K} }}\right)\right]=2{,}3\,\mathrm {bar} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/91a1ed8bf2d60355cbded0dd1167e4c4dfbd128a)
![{\displaystyle {\frac {p_{\mathrm {Wasser} }(15\,^{\circ }{\text{C}})}{p_{\mathrm {Wasser} }(14\,^{\circ }{\text{C}})}}=\exp \left[{\frac {44430\,{\frac {\mathrm {J} }{\mathrm {mol} }}}{8{,}314\,{\frac {\mathrm {J} }{\mathrm {mol} \cdot \mathrm {K} }}}}\cdot \left({\frac {1}{287{,}15\,\mathrm {K} }}-{\frac {1}{288{,}15\,\mathrm {K} }}\right)\right]=1{,}067}](http://wikimedia.org/api/rest_v1/media/math/render/svg/83dc52aab8fa83d3e55a607267dfbf7144ed1bb5)
 ...
...
