Top Qs
Chronologie
Chat
Contexte
Acide chloreux
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
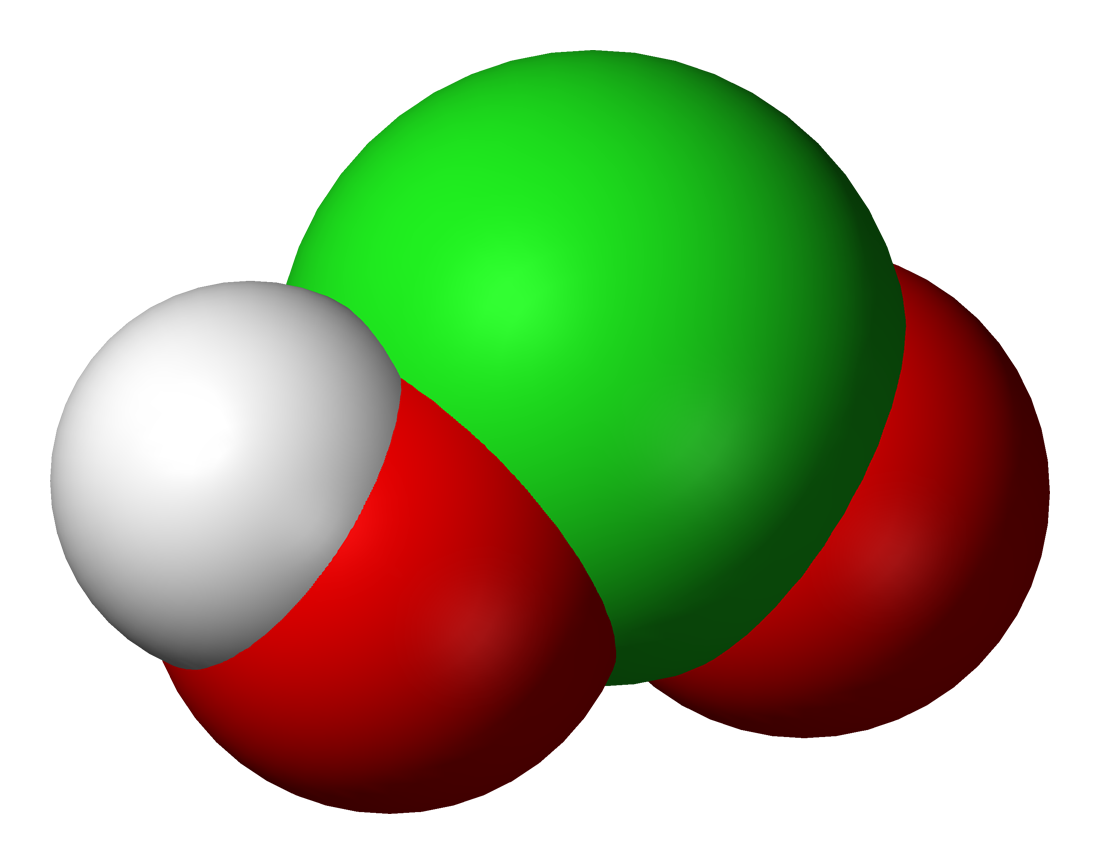
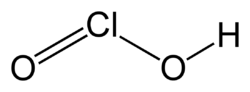
L'acide chloreux est un composé inorganique de formule brute HClO2. C'est un acide faible. L'atome de chlore y est au degré d’oxydation +III. Ce composé est instable sous forme pure.
Remove ads
Propriétés physico-chimiques
Ce composé est instable sous forme pure, il se dismute en acide hypochloreux HClO, dont l'état d'oxydation du chlore est +1, et en acide chlorique, HClO3 (état d'oxydation du chlore +5) :
- 2 HClO2 → HClO + HClO3.
En solution aqueuse froide et diluée, l'acide chloreux est en équilibre avec du dioxyde de chlore et de l'acide chlorhydrique, la forme acide chloreux étant minoritaire[4] :
- 5 HClO2 4 ClO2 + HCl + 2 H2O.
En revanche, les anions chlorite, base conjuguée de cet acide, forment des sels, tels que le chlorite de sodium, qui sont stables même à l'état pur.
Remove ads
Production et synthèse
Une solution d'acide chloreux peut être préparée en faisant réagir du chlorite de baryum avec de l'acide sulfurique dilué :
- Ba(ClO2)2 + H2SO4 → BaSO4 + 2HClO2.
Le sulfate de baryum précipite et laisse une solution d'acide chloreux.
Stabilité
Le chlore est le seul halogène pour lequel un oxoacide de formule HXO2 peut être isolé[5]. Le fluor ne possède pas d'état d'oxydation supérieur à +1 et ni l'acide bromeux, ni l'acide iodeux n'ont été isolés. D'autre part, si quelques rares sels de l'acide bromeux, les bromites, sont connus, aucun iodite ne l'est[5].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads