Top Qs
Chronologie
Chat
Contexte
Acide sulfurique
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
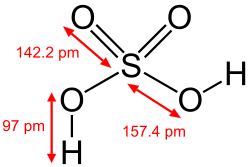
L’acide sulfurique, appelé jadis huile de vitriol ou vitriol fumant, est un composé chimique de formule H2SO4. C'est un acide minéral dont la force (pKa = –3,0) est seulement dépassée par les superacides. Il est miscible à l'eau en toutes proportions, où il se dissocie en libérant des cations hydronium :


L'acide sulfurique est un des produits chimiques industriels essentiels (avec notamment le dichlore et l'acide nitrique) du monde moderne[9], qui trouve de très nombreuses applications, notamment dans les batteries au plomb pour les voitures et autres véhicules, le traitement des minerais, la fabrication des engrais, le raffinage du pétrole, le traitement des eaux usées et les synthèses chimiques.
Issu de l'hydratation du trioxyde de soufre SO3, lui-même résultant de l'oxydation naturelle du dioxyde de soufre SO2 dans l'atmosphère terrestre où il est un polluant notoire, l'acide sulfurique est présent dans les pluies acides.
Sa grande corrosivité et les dangers qu'il représente ne sont pas tant dus à sa nature d'acide fort qu'à son avidité pour l'eau qui en fait un agent utilisé en dessiccation, capable de brûler gravement les tissus organiques. C'est la raison pour laquelle, au même titre que la soude caustique, il est beaucoup plus dangereux que l'acide chlorhydrique qui est pourtant également un acide fort.
Il est le composant principal des nuages de la planète Vénus.
Remove ads
Propriétés et réactions
Résumé
Contexte
Propriétés physiques
Acide concentré et acide dilué
L'acide sulfurique pur est un liquide visqueux, incolore et inodore. Diverses impuretés le colorent souvent en jaune brun. Sa concentration est encore parfois exprimée en degrés Baumé (symbole « °Bé »), qui mesurent la densité du liquide, laquelle varie sensiblement en fonction de la teneur en acide sulfurique (voir tableau déroulant ci-dessous).
Il peut être produit avec une pureté pratiquement égale à 100 %, mais il tend à libérer du trioxyde de soufre en se rapprochant de son point d'ébullition de 610 K (337 °C), où il donne de l'acide à 98,3 % correspondant à l'azéotrope avec l'eau en vertu de l'équilibre :
Presque tout l'acide sulfurique s'est décomposé en eau et trioxyde de soufre à 450 °C. À température plus élevée, la décomposition du trioxyde de soufre se poursuit en oxygène et dioxyde de soufre :
C'est à la concentration de l'azéotrope qu'il est le plus stable, et c'est entre 95 et 98 % (soit [H2SO4] ≈ 18 mol/l) que l'acide sulfurique dit « concentré » est distribué commercialement, avec une masse volumique de l'ordre de 1 830 kg/m3, soit 66 °Bé.
Lorsqu'il est destiné à être employé comme électrolyte pour batterie au plomb, l'acide est dilué à une concentration de 29 à 32 % (soit [H2SO4] ≈ 4,2 à 5 mol/l), avec une masse volumique de 1 250 à 1 280 kg/m3, soit environ 30 °Bé.
Oléum et acide disulfurique
À concentration élevée, l'acide sulfurique est en équilibre avec son anhydride, l'acide disulfurique :
L'acide disulfurique, également appelé acide pyrosulfurique, est en équilibre avec l'acide sulfurique et le trioxyde de soufre dans l'oléum résultant de la dissolution de trioxyde de soufre dans de l'acide sulfurique :
On exprime la teneur en SO3 dans l'oléum en pourcentage de SO3 ajouté ou en pourcentage de H2SO4 équivalent si on ajoutait la quantité d'eau nécessaire : les concentrations usuelles sont l'oléum à 40 % (correspondant à 109 % H2SO4) et l'oléum à 65 % (correspondant à 114,6 % H2SO4) ; H2S2O7 pur est un solide fondant à 35 °C.
Acidité
L'acide sulfurique est un diacide, dont la première fonction acide est forte :
H2SO4 HSO4− + H+, pKa = –3,0. HSO4− SO42− + H+, pKa = 1,9.
Seules quelques substances sont encore plus acides que l'acide sulfurique : on les appelle superacides. Ce sont essentiellement l'acide triflique HSO3CF3, l'acide magique HSO3F·SbF5 et surtout l'acide fluoroantimonique HSbF6.
Les sels de l'acide sulfurique sont des hydrogénosulfates tels que KHSO4 et NaHSO4, et des sulfates tels que CuSO4 et (NH4)2SO4.
Autoprotolyse
L'acide sulfurique anhydre est un liquide très polaire avec une permittivité de l'ordre de 100. Il est très conducteur en raison de sa forte ionisation par autoprotolyse :
- 2 H2SO4 H3SO4+ + HSO4−,
avec une constante d'équilibre valant à 25 °C :
- Ke = [H3SO4+] × [HSO4−] = 2,7 × 10–4.
La viscosité élevée de l'acide sulfurique pur, qui devrait s'opposer à la conductivité ionique du liquide, est ignorée par un mécanisme d'échange de proton intramoléculaire analogue au mécanisme de Grotthuss à l'œuvre dans l'eau.
Les espèces en équilibre dans l'acide sulfurique à 100 % ne se limitent pas à celles indiquées plus haut, et s'étendent à l'ion hydronium et à l'acide disulfurique[11] :
- 15,0 mmol kg−1 de HSO4− ;
- 11,3 mmol kg−1 de H3SO4+ ;
- 8,0 mmol kg−1 de H3O+ ;
- 4,4 mmol kg−1 de HS2O7− ;
- 3,6 mmol kg−1 de H2S2O7 ;
- 0,1 mmol kg−1 de H2O ;
ces concentrations étant exprimées en kilogramme de solvant H2SO4.
Réactions chimiques
Réaction avec l'eau
L'hydratation de l'acide sulfurique est très exothermique. On procède en versant l'acide dans l'eau, et non l'inverse, afin de contrôler la protonation de l'eau en utilisant l'acide comme facteur limitant :
- H2SO4 + H2O → H3O+ + HSO4−
- HSO4− + H2O → H3O+ + SO42−
En raison du caractère thermodynamiquement très favorable de l'hydratation de l'acide sulfurique, celui-ci est utilisé industriellement comme agent de dessiccation,[réf. nécessaire] notamment dans l'agro-alimentaire pour produire des fruits secs. Cet effet est si marqué que l'acide sulfurique peut brûler les matières organiques en ne laissant que le carbone, par exemple avec l'amidon :
- (C6H10O5)n → 6n C + 5n H2O.
L'eau libérée par cette réaction est absorbée par l'acide sulfurique, et il ne reste qu'un résidu carboné. La cellulose du papier, lorsqu'elle est attaquée par de l'acide sulfurique, prend un aspect carbonisé sous l'effet d'une réaction similaire. Sur du coton, l'acide sulfurique, même dilué, a un effet moins spectaculaire mais qui conduit malgré tout à la destruction du tissu.
Autres réactions
Comme tous les acides forts, l'acide sulfurique réagit vivement avec de nombreux produits organiques, les métaux en poudre, les carbures, les chlorates, les chromates, les nitrates, les permanganates, les fulminates, le fluosilicium et le bronze en poudre de façon très exothermique. La réaction peut être explosive.
- Avec les bases
L'acide sulfurique concentré réagit violemment avec les bases fortes anhydres ou en solutions concentrées. Cela conduit aux sulfates correspondants, tels que le sulfate de cuivre, un sel de couleur bleue couramment utilisé en galvanoplastie et comme fongicide, obtenu par réaction de l'acide sulfurique sur l'oxyde cuivrique :
- H2SO4 (aq) + CuO(s) → CuSO4 (aq) + H2O (l).
- Avec les sels
L'acide sulfurique peut également être employé pour déplacer des acides plus faibles de leurs sels, ce qu'on observe par exemple lors de la formation d'hydrogénosulfate de sodium à partir d'acétate de sodium en libérant l'acide acétique :
De façon similaire, on peut produire de l'acide nitrique en faisant réagir de l'acide sulfurique sur du salpêtre et précipiter l'hydrogénosulfate de potassium qui en résulte :
Il y a donc effervescence, avec dégagement de bulles de CO2 et « grignotage » de la roche.
- Avec l'acide nitrique
L'acide sulfurique forme avec l'acide nitrique une substance agissant à la fois comme acide et comme agent de déshydratation, donnant naissance à l'ion nitronium NO2+ qui joue un rôle important dans les nitrations par substitution électrophile aromatique. Ce type de réactions, dans lequel la protonation survient sur un atome d'oxygène, intervient dans beaucoup de réactions en chimie organique. Il est notamment employé pour fabriquer de nombreux explosifs, tels que le trinitrotoluène, la nitroglycérine et la nitrocellulose.
- Avec les métaux
L'acide sulfurique attaque les principaux métaux usuels en donnant un sulfate métallique par libération d'hydrogène. L'acide dilué attaque le fer, l'aluminium, le zinc, le manganèse, le magnésium et le nickel, mais seul l'acide concentré et chaud peut attaquer l'étain et le cuivre, tandis que le plomb et le tungstène ne sont pas attaqués. L'attaque de l'étain par l'acide sulfurique libère du dioxyde de soufre plutôt que de l'hydrogène, contrairement à ce qu'il en est pour les autres métaux :
- Fe(s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq),
- Sn(s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O(l) + SO2 (g).
Ces deux schémas réactionnels sont emblématiques : l'acide sulfurique concentré et chauffé agit généralement comme un agent oxydant, tandis que l'acide dilué agit plutôt comme un acide typique, ce qui explique que l'acide chaud concentré libère de l'eau et du dioxyde de soufre en formant des sels avec le cuivre, le zinc et l'étain, alors que l'acide dilué libère de l'hydrogène en formant le sel.
- Avec le benzène
Attaqué par l'acide sulfurique, le benzène subit une substitution électrophile aromatique conduisant à un acide sulfonique[12] :

Remove ads
Occurrence naturelle
Résumé
Contexte

Sur Terre
L'acide sulfurique n'existe pas sur Terre à l'état pur en raison de sa très forte hygroscopie. On le trouve cependant dans les pluies acides, où il résulte de l'oxydation de l'acide sulfureux H2SO3 issu de la dissolution du dioxyde de soufre SO2 dans les nuages, le dioxyde de soufre étant produit par les combustibles fossiles soufrés.
Il se forme également par oxydation de minéraux sulfurés, tels que la pyrite FeS2, et peut acidifier l'eau de ruissellement au point de former un drainage minier acide (DMA) riche en acide sulfurique :
Sur Vénus
Le dioxyde de soufre SO2 libéré notamment par le volcanisme de la planète Vénus est oxydé en trioxyde de soufre SO3 par les radicaux oxygène libérés par photodissociation du dioxyde de carbone CO2 sous l'effet du rayonnement ultraviolet de longueur d'onde inférieur à 169 nm ; ce trioxyde de soufre réagit ensuite avec les rares traces de vapeur d'eau présentes dans l'atmosphère de Vénus pour former des gouttelettes d'acide sulfurique à ~ 75 %, principalement dans les couches nuageuses s'étageant entre 52 et 58 km d'altitude, là où la pression et la température sont relativement proches de celles de la surface de la Terre :
Ces nuages produisent des virgae, c'est-à-dire des précipitations qui se vaporisent sous l'effet de la chaleur croissante à mesure qu'on se rapproche du sol, typiquement à une altitude d'une trentaine de kilomètres, lorsque la température dépasse 300 °C. L'acide sulfurique se décompose en eau et trioxyde de soufre sous l'effet de la chaleur, puis le trioxyde de soufre se décompose à son tour en dioxyde de soufre et oxygène atomique à température encore plus élevée, l'oxygène atomique tendant alors à oxyder le monoxyde de carbone CO en dioxyde de carbone CO2.
Sur Mars
Si l'acide sulfurique est aujourd'hui a priori absent de la surface martienne, il aurait peut-être été abondant dans les étendues d'eau liquide existant encore sur la planète Mars il y a près de 4 milliards d'années, à l'Hespérien, époque marquée par un intense volcanisme à l'origine de terrains géologiques aujourd'hui riches en sulfates hydratés, notamment kiesérite MgSO4·H2O[13] et gypse CaSO4·2H2O[14], correspondant à l'éon stratigraphique appelé Theiikien.
L'eau liquide martienne, sans doute abondante à l'époque précédente, le Noachien, aurait été chargée d'acide sulfurique à la suite des éruptions volcaniques de l'Hespérien, ce qui aurait à la fois pour conséquence d'abaisser sensiblement son point de congélation — l'eutectique du mélange H2SO4·2H2O – H2SO4·3H2O gèle ainsi un peu en dessous de −20 °C, et celui du mélange H2SO4·6,5H2O – H2O gèle autour de 210 K, température légèrement inférieure à −60 °C[15], qui est la température moyenne actuelle sur Mars — et de conduire à la formation de sulfates plutôt que de carbonates. Ainsi s'expliquerait pourquoi, alors que Mars possédait a priori une atmosphère de CO2 et de grandes étendues d'eau liquide, on n'y trouve quasiment pas de carbonates, alors que les sulfates semblent, au contraire, particulièrement abondants[16],[17] : la formation des carbonates est inhibée par l'acidité — que la présence de sulfates laisse supposer — (la sidérite FeCO3, a priori le carbonate le moins soluble, ne précipite qu'à pH > 5[18]) et la libération continue de SO2 par l'activité volcanique à l'Hespérien aurait déplacé le CO2 des carbonates qui auraient pu s'être formés au Noachien pour les remplacer par des sulfates, comme cela se produit par exemple à pH faible avec le magnésium :
Sur Europe
Les données obtenues par la sonde Galileo en spectroscopie infrarouge sur le satellite Europe de la planète Jupiter présentent des absorptions caractéristiques, interprétées comme provenant peut-être d'hydrates d'acide sulfurique. Dans la mesure où la dilution d'acide sulfurique dans de l'eau provoque un abaissement significatif du point de congélation, jusqu'à −60 °C pour certains mélanges, cela renforcerait la probabilité d'existence d'une couche de solutions aqueuses d'acide sulfurique à l'état liquide sous l'écorce gelée d'Europe. Cependant, l'absorption infrarouge observée par Galileo sur Europe pourrait également provenir de minéraux riches en ions sulfate[19].
Remove ads
Production
Résumé
Contexte
L'acide sulfurique est aujourd'hui essentiellement fabriqué par le procédé dit « de contact », faisant intervenir un catalyseur, mais d'autres procédés sont également mis en œuvre à plus petite échelle.
En dehors des produits pétroliers, l'acide sulfurique est le produit le plus fabriqué par l'industrie chimique.
Hydratation du trioxyde de soufre
La manière intuitivement la plus simple de produire H2SO4 est de dissoudre SO3 dans H2O, mais cette réaction est tellement exothermique qu'elle n'aboutit, lorsqu'elle est réalisée à grande échelle sans être suffisamment maîtrisée, qu'à produire de la vapeur d'eau et très peu d'acide.
La voie humide met en œuvre cette réaction en deux étapes. D'abord, de l'acide sulfurique est produit à l'état gazeux par hydratation du trioxyde de soufre :
Puis, l'acide est condensé à l'état liquide pour produire de l'acide sulfurique concentré à environ 98 % :
- H2SO4 (g) → H2SO4 (l) : ΔH = −69 kJ mol−1.
Le SO3 utilisé dans cette réaction provient essentiellement de l'oxydation catalytique de SO2 (voir au paragraphe suivant), lequel peut provenir de la simple combustion du soufre dans l'oxygène ou de celle du sulfure d'hydrogène H2S, qui se déroule entièrement à l'état gazeux :
Procédé de contact
C'est le procédé industriel aujourd'hui le plus largement mis en œuvre, appelé « procédé de contact » car il requiert le contact avec un catalyseur. Il se décompose en trois étapes :
- purification du soufre S et combustion du soufre à l'air sec pour obtenir du dioxyde de soufre SO2 ou purification du SO2 s'il n'est pas obtenu à partir de soufre ;
- oxydation du dioxyde de soufre en trioxyde de soufre SO3 à l'aide de pentoxyde de vanadium V2O5 ;
- conversion du trioxyde de soufre en acide sulfurique H2SO4.
La purification du S ou du SO2 est nécessaire pour éviter l'empoisonnement du catalyseur de l'étape n° 2 par des impuretés. On utilisait autrefois du platine plutôt que du vanadium, un peu moins efficace, mais le platine est plus cher et plus facilement inhibé par des impuretés[20]. Le mécanisme de la réaction d'oxydation catalysée est le suivant :
- a) 2 SO2 + 4 V5+ + 2 O2− → 4 V4+ + 2 SO3 ;
- b) 4 V4+ + O2 → 4 V5+ + 2 O2− ;
la réaction globale s'écrivant :
On atteint 96 % de rendement chimique avec V2O5 en maintenant une température de 450 °C et une pression de 100 à 200 kPa ; le catalyseur ne sert qu'à optimiser la cinétique de la réaction, mais n'en déplace pas l'équilibre.
Le trioxyde de soufre est ensuite refroidi dans un échangeur thermique et recueilli dans une tour d'absorption où il est dissous dans de l'acide sulfurique concentré afin de produire de l'oléum :
- H2SO4 (l) + SO3 (g) → H2S2O7 (l),
qui est ensuite hydraté pour libérer de l'acide sulfurique, avec un rendement moyen de 30 % :
- H2S2O7 (l) + H2O(l) → 2 H2SO4 (l).
Procédé des chambres de plomb
C'est le procédé historique de production industrielle de l'acide sulfurique, largement supplanté au XXIe siècle par le procédé de contact. Il assurait néanmoins encore la moitié de la production d'acide sulfurique jusqu'au milieu du XXe siècle.
Le procédé des chambres de plomb, dans sa version la plus moderne (procédé Petersen), s'effectue par une réaction entre du dioxyde de soufre, de l'eau et de l'oxygène, qui se combinent pour donner l'acide sulfurique. Cette réaction est catalysée par des oxydes d'azote continuellement recyclés.
Introduit par John Roebuck en 1746, ce procédé fournit un acide sulfurique moins concentré et contenant plus d'impuretés, plutôt destiné à la fabrication des superphosphates.
Préparation en laboratoire
L'acide sulfurique peut être préparé en petite quantité en faisant brûler du soufre élémentaire pour produire du dioxyde de soufre SO2, qu'on dissout ensuite dans du peroxyde d'hydrogène H2O2 :
Remove ads
Régénération d'acide sulfurique (RAS)
Résumé
Contexte
La demande publique et citoyenne est celle d'une économie industrielle plus soutenable et moins émettrice de carbone. Dans le contexte (début XXIe siècle) qui voit encore croître d'une part la demande industrielle d'acide sulfurique, et d'autre part la quantité de déchet-acide sulfurique usagé (dans les raffineries pétro-gazières surtout, qui l'utilisent comme catalyseur du procédé d’alkylation) et qui doivent traiter des pétroles de plus en plus sales), le recyclage, après régénération, de cet acide semble être une activité devenue rentable. Cette réutilisation intéresse le secteur du raffinage pétrogazier, qui ainsi diminue ses couts de gestion des acides usagés, tout en affichant un effort en termes d'économie circulaire[21].
Cet acide régénéré et éventuellement concentré et purifié[22] pourrait être utilisé pour la fabrication de batteries, d’engrais, de fibres synthétiques, de produits cosmétiques et surtout pour le raffinage du pétrole, mais il est moins pur (ou alors plus cher parce que mieux retraité). Il semble aujourd'hui (2022) revendu à des dizaines de raffineries, ou destiné à la fabrication de savons, shampooings, lessives et autres détergents, produits cosmétiques, notamment[21] ou pour la régénération d'huiles usagées[23],[24] ou d'autres produits pétroliers[25].
Veolia qui en 2016 a acheté les actifs de la division « Produits sulfurés » de l'américain Chemoursse se présente[21] comme leader pour le retraitement de l'acide sulfurique (à partir de déchet de raffinerie) avec plus de 20 % du marché, trois unités de récupération de l’acide sulfurique dans le Delaware, le New Jersey et au Texas ; un site de récupération de l’acide sulfurique et de produits sulfuriques à Burnside (en), en Louisiane ; et quatre usines de production d’acide sulfurique sur la côte-Est.[passage promotionnel]
Remove ads
Sécurité
Résumé
Contexte
L'acide concentré et l'oléum réagissent avec l'eau en dégageant une grande chaleur. C'est pour cela qu'en milieu industriel, une dilution d'acide se fait toujours sous refroidissement. Il en est de même au contact avec la peau ce qui peut provoquer de graves brûlures. Il faut verser l'acide dans l'eau et non l'inverse : notamment parce que la densité de l'eau est moindre que celle de l'acide sulfurique, la faisant ainsi flotter au-dessus de l'acide et l'eau en plus grande quantité au départ de la dilution sert à dissiper la chaleur. Dans l'autre sens, l'exothermie peut faire bouillir subitement l'eau versée sur l'acide, ce qui cause des projections d'eau et d'acide très dangereuses.
L'inhalation de fumées et brouillards d'acide peut causer des lésions à long terme. La réglementation américaine et française limite à 1 mg·m-3 la concentration moyenne admissible pendant un poste de travail.
L'acide sulfurique est ininflammable, mais à des concentrations inférieures à 75 %, il réagit avec l'acier carbone et d'autres métaux en dégageant du dihydrogène qui, lui, est combustible.
Les épandages d'acide sulfurique peuvent être dilués avec une grande quantité d'eau, tandis que ceux d'oléum seront de préférence traités par un absorbant solide (argile).
L'acide sulfurique réagit avec des sulfures en libérant du sulfure d'hydrogène gazeux très toxique.
En France, l'acide sulfurique fait l'objet de la fiche INRS no 30.
Remove ads
Utilisations
Résumé
Contexte




Parmi les utilisations de l'acide sulfurique, on peut citer :
- fabrication d'acide phosphorique par attaque du phosphate de calcium ;
- fabrication d'engrais tels que les superphosphates, le sulfate d'ammonium ;
- industrie des textiles artificiels ;
- traitement des minerais ;
- synthèse de composés chimiques (colorants, explosifs, détergents, divers sels, autres acides, etc.) ;
- raffinage du pétrole ;
- déshydratation des alcools, pour donner des alcènes ;
- batteries au plomb (H2SO4 est alors connu sous le nom d'« acide de batterie ») ;
- extraction de l'uranium par le procédé de lixiviation in situ ;
- décapage de métaux en sidérurgie ;
- sulfonation ;
- déshydratation (d'aliments par exemple) ;
- fabrication de l'acide de Caro, un oxydant puissant utilisé en nettoyage ;
- catalyse de réactions d'estérifications grâce à l'ion oxonium ;
- dilué d'un volume pour dix d'eau, cet acide est couramment utilisé dans le décapage des métaux précieux en bijouterie après brasage, cette solution s'appelle dérocher ;
- traitement de l'eau, sert à faire diminuer le pH du sol en horticulture maraîchère ;
- industrie du traitement de surface des matériaux, notamment composition du bain d'anodisation ;
- l’acide sulfurique a été utilisé au XIXe siècle pour la conservation de la viande.
Remove ads
Historique
Résumé
Contexte
En français, à la fin du XIe siècle, vedriol apparaît pour désigner le sulfate de fer. On trouve, à la même époque, vitriolo, sans définition chimique, mais avec la traduction arabe alzag[26]. Forme syncopée de vitri oleum (littéralement « huile de verre »), le mot vitriolum désigne au Moyen Âge et à la Renaissance diverses substances d'aspect huileux ou vitreux, liquides ou solides, le futur acide sulfurique n'étant que l'une d'entre elles. Au XIIe siècle, les tossafistes Rabbenou Tam et Rashbam parlent de vidriolo et de vidriol « qui est vert comme du verre, d'où son nom »[27],[28]. Au XVe siècle, on obtenait l'acide sulfurique en distillant du sulfate ferreux hydraté, ou vitriol de fer, avec du sable.
Cette technique plus ou moins secrète sera révélée à la Renaissance avec l’arrivée de l’imprimerie. Conrad Gesner donne la description dans Trésor des remèdes secrets[29] (1552) p. 331-332 de la distillation du vitriol romain pour faire l’« huyle de vitriol ». Un siècle plus tard, Nicolas Lémery dans son Cours de chymie[30], ouvrage de synthèse des connaissances empiriques de chimie du siècle, décrira les différentes étapes de la distillation du vitriol, permettant d’obtenir successivement l’esprit sulfureux du vitriol (SO2), l’esprit acide de vitriol (solution de acide sulfurique H2SO4) et ce qui reste dans la cucurbite, l'huile de vitriol (acide sulfurique concentré).
La fabrication du dihydrogène par action de l'acide sulfurique sur du fer est connue depuis longtemps. L'alchimiste du XVIe siècle, Paracelse, entrevoit le dihydrogène qu'il produit par réaction entre le vitriol et le fer. En 1603, Théodore de Mayerne enflamme le dihydrogène obtenu par le même moyen. À partir de 1783, date de leur invention, les ballons à gaz utiliseront entre autres gaz, du dihydrogène produit par réaction de l'acide sulfurique sur des copeaux de fer[31].
Au XIXe siècle, Justus von Liebig découvrit que l'acide sulfurique répandu dans le sol augmentait la quantité de phosphore disponible pour les plantes.
Berkeley Pit est une fosse massive remplie d'eau chargée d'acide sulfurique et de métaux lourds à des taux très dangereux, à cause d'une ancienne mine fermée en 1982. En 1995, on y trouva 342 oies mortes après leur atterrissage sur l'eau toxique.
Remove ads
Vitriol et alchimie
Résumé
Contexte

Le mot vitriolum se lit au XIIIe siècle, dans le Grand Albert (écrit par un Pseudo-Albert le Grand).
Selon Eugène Canseliet, le vitriol a pour synonymes le « lion vert » (chez Ripley), « l'émeraude des sages ».
« Le vitriol ordinaire, c'est-à-dire le sulfate de fer ou couperose du commerce, ne doit pas être confondu avec le vitriol des philosophes, loirs même que Basile Valentin en eût fourni le procédé très simple de fabrication, qui consiste, sans plus, à calciner deux parties égales de soufre et de fer en limaille, et à mettre le sulfure obtenu en digestion, au sein de l'eau de pluie. Le Rosaire des philosophes — Rosarium Philosophorum — le premier, établit la différence[32]. »
Les alchimistes donnent au terme « vitriol » une signification ésotérique, en l’interprétant comme un acronyme de Visita Interiora Terrae Rectificandoque Invenies Occultum Lapidem qui peut se traduire par « Visite l'Intérieur de la Terre, et en Rectifiant tu Trouveras la Pierre Cachée ».
Le premier à le signaler est, semble-t-il, Gérard Dorn, un disciple de Paracelse, dans Congeries paracelsicae chemiae de transmutationibus metallorum, 1581, p. 144. L'idée prend corps chez Basile Valentin ; des gravures en ce sens se trouvent dans l'édition 1653 de l' Azoth de Basile Valentin (paru en 1624). On trouve l'emblème chez Johann Neithold Aureum Vellus; oder Güldenes Vleiss, Frankfurt (1733), mais, avant, sur le frontispice de l'édition de 1613 de La Toyson d'Or par Salomon Trismosin[33] ,[34]. Dans son Testament (1651), Basile Valentin écrit ceci :
« Le Vitriol est un notable et important minéral auquel nul autre, dans la nature, ne saurait être comparé, et cela parce que le Vitriol se familiarise avec tous les métaux plus que toutes les autres choses ; il leur est très prochainement allié, puisque, de tous les métaux, l’on peut faire un vitriol ou cristal ; car le vitriol et le cristal ne sont reconnus que pour une seule et même chose… Car, bien que tous les métaux et minéraux soient doués de grandes vertus, celui-ci néanmoins, savoir le Vitriol, est seul suffisant pour en tirer et faire la bénite pierre [philosophale], ce que nul autre au monde ne pourrait accomplir seul à son imitation. »
Pierre-Jean Fabre, médecin et alchimiste de Castelnaudary, dans son Abrégé des secrets chymioques (1636) lut dans « vitryol » l'anagramme « l'or y vit ».
Remove ads
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads