Top Qs
Chronologie
Chat
Contexte
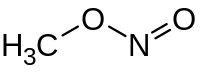
Nitrite de méthyle
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
Le nitrite de méthyle est un composé organique, le plus simple de la famille des nitrites d'alkyle. C'est un gaz incolore particulièrement instable, toxique et inflammable.
Remove ads
Propriétés
A température ambiante, le nitrite de méthyle existe sous la forme d'un mélange de conformères cis et trans. La forme cis est plus stable de 3,13 kJ mol−1 que la forme trans, avec une barrière d'énergie de rotation de 45,3 kJ mol−1[3].
 |  |
| cis-nitrite de méthyle | trans-nitrite de méthyle |
Le nitrite de méthyle est un agent oxydant et un explosif sensible à la chaleur ; cette sensibilité s'accroît en présence d'oxydes métalliques. Il explose plus violemment que le nitrite d'éthyle. Il forme des sels explosifs avec les bases inorganiques, ainsi que des mélanges explosifs avec l'air.
Le nitrite de méthyle est un gaz asphyxiant toxique, un puissant agent cyanotique. L'exposition peut entraîner une méthémoglobinémie[4].
Remove ads
Production et synthèse
Le nitrite de méthyle peut être préparé par réaction entre le nitrite d'argent et l'iodométhane. L'un des doublets libres de l'oxygène de l'ion nitrite va attaquer le groupe méthyle (—CH3), libérant de l'iode en solution[5]. Contrairement au nitrite d'argent, l'iodure d'argent est particulièrement insoluble dans l'eau, et forme donc un dépôt solide[6]. À noter cependant que l'azote du groupe nitrite est bien plus nucléophiles que l'oxygène, et donc la plupart des ions nitrites vont réagir par un méacanisme de type SN2 pour produire du nitrométhane. Par exemple, si on faisait réagir du nitrite de sodium ou du nitrite de potassium avec l'iodométhane, on obtiendrait quasiment uniquement du nitrométhane, et très peu de nitrite de méthane. L'utilisation de nitrite d'argent permet au contraire de stabiliser la formation d'un intermédiaire de type carbocation qui favorise la formation de nitrite de méthyle, faisant grimper le rendement, même si du nitrométhane est toujours produit[5].
Le nitrite de méthyle est aussi produit par la combustion de l'essence sans plomb, et pourrait être la cause du déclin d'insectes, ainsi que du moineau domestique et d'autre Passeri en Europe[7].
Remove ads
Utilisations
Du fait de ses propriétés explosives, le nitrite de méthyle est utilisé comme monergol[8].
C'est également un précurseur et un intermédiaire en synthèse organique. Il est par exemple utilisé durant la synthèse de la phénylpropanolamine[4], ou comme agent de méthylation par carbonylation oxydante[9].
Voir aussi
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads