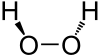Peróxido de hidróxeno
composto químico From Wikipedia, the free encyclopedia
Remove ads
O peróxido de hidróxeno que, en solución acuosa, é coñecido comercialmente como auga osixenada, é un líquido claro de fórmula química H2O2. É un pouco máis viscoso que a auga, ten propiedades oxidantes fortes, é incoloro á temperatura ambiente e ten un característico sabor amargo. Ten propiedades oxidantes fortes, polo que é un axente branqueador moi poderoso. Emprégase como desinfectante, oxidante e como propelente en foguetes[3].
O peróxido de hidróxeno é unha especie reactiva de osíxeno e é o peróxido máis simple, xa que ten un único enlace osíxeno-osíxeno. Decomponse a modo cando se expón á luz, e rapidamente na presenza de compostos orgánicos ou reactivos. Gárdase normalmente cun estabilizador nunha solución lixeiramente acídica nunha botella escura que impide o paso da luz. O peróxido de hidróxeno se atopa en sistemas biolóxicos, incluído o corpo humano. Enzimas que usan ou descompoñen o peróxido de hidróxeno se clasifican como peroxidasas.
Remove ads
Estrutura
O peróxido de hidróxeno e unha molécula non planar cunha simetría (retorta) C2; isto foi mostrado por primeira vez por Paul-Antoine Guiguère en 1950 usando espectroscopía de infravermellos[4][5]. Aínda que o enlace O-O é un enlace sinxelo, esta molécula ten unha barreira de rotación entre enantiómeros relativamente alta, de 386cm-1 (4.62 kJ/mol) mediante a configuración trans, e 2460 cm−1 (29.4 kJ/mol) mediante a configuración cis[6]. Crese que estas barreiras son causadas pola repulsión entre os pares solitarios de electróns dos átomos de osíxeno adxacentes e os efectos dipolares entre os enlaces O-H. Para comparar, a barreira rotacional do etano (C2H6) é 1040 cm−1 (12.4 kJ/mol).
O ángulo dihedral de aproximadamente 100° entre os dous enlaces O-H fai que esta molécula sexa quiral. Trátase do enantiómero máis pequeno e simple. Relacionado con isto, propúxose que as interaccións enantioespecíficas dun enantiómero en vez doutro puideran levar a amplificación dunha forma enantiomérica dos ácidos ribonucleicos, dando así á orixe da homoquiralidade no mundo do ARN[7].
Remove ads
Comparación con compostos análogos
O peróxido de hidróxeno ten varios análogos estruturais con tipos de enlace Hm-X-X-Hn (na táboa inferior se inclúe a auga para comparación). Ten o máis alto punto teórico de ebulición desta serie (X = O, N, S). O seu punto de fusión é tamén bastante alto, comparable ao da hidracina e auga: soamente hidroxilamina cristaliza máis rápido de forma significativa, indicando a gran forza das pontes de hidróxeno do peróxido de hidróxeno. Difosfano e disulfuro de hidróxeno posúen débiles pontes de hidróxeno e teñen pouca similitude química co peróxido de hidróxeno. Estruturalmente falando, estes análogos todos adoptan estruturas tortas similares, debido á repulsión entre os adxacentes pares solitarios de electróns.
Remove ads
Descubrimento
Foi descuberto por Louis Jacques Thénard en 1818 como resultado da mestura de peróxido de bario con ácido nítrico (tamén descubriu que, substituíndo o ácido nítrico con ácido clorhídrico, o proceso melloraba). O peróxido de hidróxeno fórmase conxuntamente co cloruro de bario, sendo ambos solubles en auga. O cloruro de bario pódese eliminar precipitándoo mediante o uso de ácido sulfúrico[8],[9].
A determinación da estrutura molecular do peróxido de hidróxeno resultou ser moi difícil. En 1892, o físico-químico italiano Giacomo Carrara (1864-1925) determinou o seu peso molecular por descenso crioscópico, o cal confirmou que a súa fórmula molecular era H2O2 [10]. Como mínimo media ducia de hipotéticas estruturas moleculares parecían consistentes coa evidencia dispoñible[11]. En 1934, o matemático inglés William Penny e o físico escocés Gordon Sutherland propuxeron a estrutura molecular do peróxido de hidróxeno que era moi similar á actualmente aceptada[12], [13].
Remove ads
Produción industrial
A día de hoxe, o peróxido de hidróxeno manufactúrase case de forma exclusiva polo proceso da antraquinona, que foi orixinalmente desenvolvido por BASF en 1939. Este proceso comeza pola redución dunha antraquinona (como a 2-etilantraquinona ou o 2-amil derivativo) á correspondente antrahidroquinona, típicamente por hidroxenación sobre un catalizador de paladio. Na presenza de osíxeno, a antrahidroquinona se autoxida: os átomos febles de hidróxeno dos grupos hidroxi transfírense á molécula de osíxeno, para dar lugar ao peróxido de hidróxeno, rexenerando á antraquinona neste proceso. A maioría dos procesos comerciais conseguen esta oxidación burbulleando aire comprimido a través dunha solución de antrahydroquinona. O peróxido de hidróxeno se extrae da solución e a antraquinona se recicla para repetir os ciclos de hidroxenación e oxidación[14],[15].
A reacción neta do proceso catalizado pola antraquinona é[16]:
O prezo do proceso depende moito da reciclaxe efectiva dos solventes de extracción, do catalista hidroxenador e da quinona, que adoita ser cara.
Remove ads
Dispoñibilidade
O peróxido de hidróxeno está normalmente dispoñible como unha solución en auga. Está normalmente dispoñible en farmacia a unha concentración 3 e 6% (peso/peso). Para o seu uso en laboratorio, as solucións máis comúns son de 30% (peso/peso, equivalente a 9.8M). Solucións de peróxido de hidróxeno con concentracións máis altas tamén están dispoñibles, pero dado o potencial de solucións maiores de 68% de convertirse en vapor de auga e oxíxeno, e a temperatura deste vapor incrementando canto máis alta sexa a concentración, estas solucións son moito máis perigosas de manipular e precisan de coidados especiais e do seu almacenamento en áreas dedicadas.
Remove ads
Produción e metabolismo do peróxido de hidróxeno celular
O peróxido de hidróxeno prodúcese en humanos e outros animais como un produto de relativa curta vida en procesos bioquímicos. A concentracións elevadas (>0.1μM) é tóxico para as células [17]. Isto débese á oxidación de proteínas, membranas lipídicas e ADN. Este dano pode deberse á reacción directa do peróxido de hidróxeno ou a súa decomposición (en presenza de metales) no radical hidroxilo (OH·), un composto altamente oxidante que oxida case calquera molécula que se atope arredor [18].
A principal fonte do peróxido de hidróxeno celular provén da dismutación do anión superóxido (O2–·), ben de forma espontánea ou catalizada pola enzima superóxido dismutasa (SOD).
2 O-·
2 + 2 H+
→ O
2 + H
2O
2
As principais fontes de produción do anión superóxido en humanos e outros animais son: (i) as NADPH oxidasas, presentes nas membranas celulares, e (ii) os complexos I e III da cadea de transporte de electróns mitocondrial[19],[20]. Ademais, existe produción directa de peróxido de hidróxeno no peroxisoma, que posúe enzimas que producen peróxido de hidróxeno a partir da oxidación de ácidos graxos, D-amino ácidos e xantina, entre outros compostos[21].
Hai dous grupos principais de enzimas que descompoñen o peróxido de hidróxeno:
(i) A catalasa, que descompón 2 moléculas de peróxido de hidróxeno en auga e osíxeno, grazas ao seu grupo hemo no sitio activo[22].
(ii) A tiol peroxidasa, que descompón 1 molécula de peróxido de hidróxeno en auga, grazas a un extremadamente reactivo grupo tiol do aminoácido cisteína no seu sitio activo (citación requirida). Neste proceso un dos átomos de oxíxeno se transfire ao grupo tiol (R-SH), xerando un intermediario coñecido como ácido sulfénico (R-SOH) (citación requirida). Este intermediario é de vida curta e tende a reaccionar cun grupo tiol veciño (outra cisteína da mesma proteína ou dunha proteína veciña), xerando un disulfuro (R-S-S-R') e liberando unha molécula de auga.[23].
(iii) A glutatión peroxidasa, que descompón 1 molécula de peróxido de hidróxeno en auga. O mecanismo é similar ao da tiol peroxidasa pero emprega un grupo selenol, do aminoácido non canónico selenocisteína[24].
Remove ads
Información xeral
O peróxido de hidróxeno gasoso aparece naturalmente en cantidades pequenas no aire. É inestábel e descomponse rapidamente en osíxeno e auga con liberación de calor. Aínda que non sexa inflamábel, é un axente oxidante poderoso que pode causar a combustión espontánea en contacto con materia orgánica ou algúns metais como o cobre ou o bronce.
Atópase en concentracións baixas (3-9%) en moitos produtos domésticos de uso medicinal e como clarexador da roupa e o cabelo. Na industria, o peróxido de hidróxeno emprégase en concentracións máis elevadas para clarexar tecidos e pasta de papel, como combustíbel para axuste e corrección nas traxectorias de naves espaciais. Na medicina utilízase como desinfectante ou axente esterilizante en autoclaves de plasma. Na área química úsase como compoñente da espuma de goma orgánica e outras substancias químicas. Tamén se utiliza para medir a actividade dalgunhas enzimas, como a catalase.
Tamén se lle fai actuar en diversos mecanismos de degradación de aminoácidos (en asociación con amino-oxidases), por causa do seu poder oxidante elevado. Pode actuar tamén na fotosíntese (ciclo do glioxilato) e na síntese de glicosa a partir de fontes que non conteñan carbohidratos (gliconeoxénese).
A auga osixenada utilízase tamén nos branqueamentos dentarios. Colócase na superficie dos dentes e actívase mediante un LED que facilita a penetración no esmalte dentario, actuando sobre os compostos cromóforos (confiren cor), quer da dentina, quer do esmalte, alterándoos ou eliminándoos.
O control do ASSET para probar vehículos non tripulados de reentrada atmosférica subescalados levaba propulsores de reacción de peróxido de hidróxeno.
Remove ads
Notas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads