SNAP25
From Wikipedia, the free encyclopedia
Remove ads
A proteína asociada ao sinaptosoma 25 (SNAP25 ou SNAP-25 do inglés sinaptosomal-associated protein 25) é unha proteína t-SNARE de 25 kDa que está codificada en humanos no xene SNAP25 situado no cromosoma 20, que intervén na fusión das membranas das vesículas sinápticas durante a neurotransmisión.[1] A SNAP-25 é un compoñente do complexo trans-SNARE, o cal se propón para explicar a especificidade da fusión de membranas e para executar directamente a fusión ao formar un complexo apertado que une a membrana da vesícula sináptica cargada de neurotransmisor e a membrana plasmática da neurona presináptica.[2]
 | |
| PDB 1jth | |
Proteína asociada ao sinaptosoma 25 (Synaptosomal-associated protein, 25kDa) | |
| Identificadores | |
| Símbolo | SNAP25 |
| Símbolos alt. | SNAP-25; CMS18; RIC-4; RIC4; SEC9; SNAP; bA416N4.2; dJ1068F16.2 |
| Entrez | 6616 |
| OMIM | |
| RefSeq | NP_003072 |
| UniProt | P60880 |
| Outros datos | |
| Locus | Cr. 20 :(10.22 – 10.31 Mb) |
Remove ads
Estrutura e función
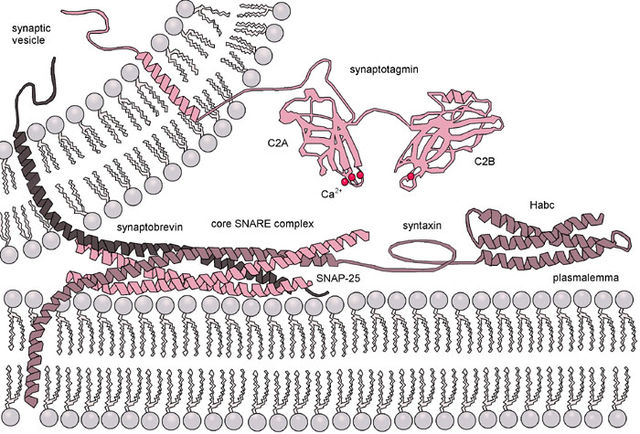
A SNAP-25 é unha proteína Q-SNARE, ancorada na cara citosólica da membrana plasmática por medio de cadeas laterais palmitoíl unidas covalentemente a residuos do aminoácido cisteína do medio da molécula. Isto significa que SNAP-25 non contén un dominio transmembrana.[4]
A SNAP-25 foi identificada como a molécula que contribúe con dúas hélices α ao complexo SNARE, que é un dominio formado por un complexo de catro hélices α.[5] O complexo SNARE participa na fusión de vesículas, o cal implica o atraque e a fusión dunha vesícula coa membrana plasmática para realizar a exocitose. A sinaptobrevina, unha proteína que pertence á familia da proteína de membrana asociada a vesículas (VAMP), e a sintaxina-1 tamén contribúen a formar o conplexo SNARE proporcionando unha hélice α cada unha. A SNAP-25 ensámblase coa sinaptobrevina e a sintaxina-1 e a unión selectiva destas proteínas permite que se produza o atraque de vesículas e a fusión na súa correcta localización.[6]
Para formar o complexo SNARE, a sinaptobrevina, sintaxina-1, e SNAP-25 asócianse e empezan a enrolarse unha sobre as outras para formar unha estrutura cuaternaria de hélice superenrolada (coiled coil). As hélices α da sinaptobrevina e da sintaxina-1 únense ás da SNAP-25. A sinaptobrevina únese á hélice α preto do C-terminal de SNAP-25, mentres que a sintaxina-1 se une á hélice α preto do N-terminal.[4]
A SNAP-25 inhibe as canles de calcio reguladas por voltaxe dos tipos P, Q, e L presinápticos[7] e interacciona co dominio C2B da sinaptotagmina de modo independente do Ca2+.[8] En sinapses glutamatérxicas, a SNAP-25 fai diminuír a resposta ao Ca2+, mentres que está ausente de forma natural en sinapses GABAérxicas.[9]
Hai dúas isoformas (variantes de splicing alternativo do ARNm) da SNAP-25, que se denominan A e B. Hai nove diferenzas en residuos de aminoácidos entre estas dúas isoformas, incluíndo unha relocalización dun dos catro residuos de cisteína.[10] As principais características destas isoformas son as que se indican na táboa:
Remove ads
Importancia clínica
En correspondencia coa súa resposta á regulación do Ca2+ sináptico, a deleción en heterocigotos do xene da SNAP-25 en ratos ten como resultado un fenotipo hiperactivo similar ao do trastorno por déficit de atención con hiperactividade (TDAH). En ratos heterocigotos, obsérvase unha diminución na hiperactividade tratándoos con dextroanfetamina (ou Dexedrina), un ingrediente activo do fármaco para TDAH Adderall. As delecións homocigotas do xene de SNAP-25 son letais. Estudos posteriores suxeriron que polo menos algunhas das mutacións no xene de SNAP-25 en humanos poderían predispoñer ao TDAH.[12][13]
Un estudo de asociación de xenoma amplo sinalou que o polimorfismo rs362584 neste xene estaba posiblemente asociado co trazo de personalidade de neuroticismo.[14] A toxinas botúlicas A, C e E clivan o SNAP-25[15] o que orixina a parálise no botulismo clinicamente desenvolvido.
Remove ads
Interaccións
A SNAP-25 presenta interaccións con:
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads