Hármaspont
From Wikipedia, the free encyclopedia
Remove ads
A hármaspont olyan hőmérséklet és nyomás, amely találkozási pontja három termodinamikai halmazállapotnak. Első megközelítésben ezek: a szilárd, a cseppfolyós és a légnemű. A Gibbs-féle fázistörvény írja le a fázisok, a komponensek és a szabadsági fokok számának összefüggését. Grafikai tekintetben a nyomás–hőmérséklet diagramon a halmazállapotokat (általánosabban fogalmazva: a fázisokat) vonalak választják el egymástól. Ha két fázis lenne, azokat egyetlen vonal választaná el egymástól. Tekintettel azonban arra, hogy három alapvető halmazállapot létezik, ezek szükségképpen egy pontban találkoznak.

A Gold Book értelmezése szerint valamennyi fázisátalakuláshoz rendelhető hármaspont. Példaképpen a kén módosulatait sorolja fel: a rombos és monoklin formák szilárd halmazállapotúak, de átalakulásuk hőmérsékleti és nyomásadatokkal írható le.[2][3]
A hármaspontok száma Nh kiszámítható a fázisok p számából:
Remove ads
Típusai
A kén hármaspontja 119 °C. Alacsonyabb hőmérsékleten szilárd halmazállapotban van, monoklin (β) kristályszerkezettel. Magasabb hőmérsékleten átmegy légnemű állapotba (gőz). Ha növekszik a nyomás, akkor az anyag átmegy cseppfolyós halmazállapotba. Van a kénnek más típusú hármaspontja is. 95,3 °C-on a monoklin kén átkristályosodik rombos formába. Itt tehát két szilárd és egy légnemű fázis találkozik. Magasabb nyomáson találunk egy további hármaspontot. 155 °C-on a kén lehet rombos, monoklin és cseppfolyós. Ezek a kén legismertebb fázisátalakulásait leíró jelenségek; a kénnek valójában 30-nál is több allotrop módosulata létezik. Ezeket görög betűkkel azonosítjuk, de a Young[1] közlemény eltérő jelölésmódot használ. Nem jelöli például a légnemű halmazállapotot (különlegessége, hogy még a légnemű halmazállapotnak is van két módosulata: S2 és S3). Alacsony hőmérsékleten túlhűtött folyadékként tárgyalják.[4] A kén hármaspontjának egyértelmű meghatározása bonyolult kérdés, mert különféle összetételű elegyként jelenik meg (S, S2, S3, S6, ciklusos stb.)[5] Jó minőségű fázisdiagram található Steven Zumdahl könyvében[6]
Az etil-alkoholnak több hármaspontja van.[7][8]
- 150 K: cseppfolyós–légnemű–szilárd (crystaline I)
- 127,5 K: crystaline II–folyadék
- 111,4 K: cystaline I–crystaline II (átkristályosodik). A crystaline II feltételezhetően az üvegesedési átmenet (glass transition)[9]
Butil-alkohol és más anyagok viselkedéséről filmfelvétel tekinthető meg a World News nevű szolgáltatónál,[10] illetve a youtube-on[11]
Hasonlóan többféle hármaspont jellemző a foszforra is. Például a foszfor hármaspontja 579°C, 44 bar. Ebben a pontban találkozik a fázisdiagramon a vörös foszfor, a fehér foszfor (mindkettő szilárd) a folyadékkal és a légnemű foszforral. Tehát a foszfor nem lehet cseppfolyós állapotú 579° alatti hőmérsékleten, de 44 bar nyomás alatt sem.
Remove ads
Termodinamikai állapotjelzők
A hagyományos nyomás–hőmérséklet diagramot kiegészítjük a harmadik állapotjelzővel. Ez a fajlagos térfogat (az ábrán: specific volume). Ezzel a gáztörvény valamennyi állapotjelzője értelmezhetővé válik. A szilárd halmazállapot (az ábrán: solid) térfogata a legkisebb. Olvadás közben az anyagok térfogata növekszik attól függően, hogy mekkora része olvadt már fel az anyagnak (az ábrán solid-liquid). A folyadékot ábrázoló területen (az ábrán: liquid) egy izotermát megrajzoltak. Ez függőleges a folyadékok összenyomhatatlansága miatt. Elérve a folyadék alsó határgörbét, elkezdődik a forrás, illetve párolgás (az ábrán: liquid-vapor). Attól függően, hogy az anyagnak mekkora része párolgott el, folyamatosan növekszik a térfogat. A felső határgörbét elérve telített gőzzé alakul. Ettől az állapottól jobbra (magasabb hőmérsékleten) az anyag gőz állapotban van (az ábrán: vapor). Gáznak csak akkor nevezzük, ha hőmérséklete magasabb a kritikus hőmérsékletnél. Az ábrán a gas felirat a kritikus izotermán szerepel.

A hármaspont (az ábrán: triple line) hőmérséklete alatt az anyag nem fordulhat elő cseppfolyós halmazállapotban. Ilyen körülmények között a szilárd anyag közvetlenül légnemű állapotba megy át. Ez a szublimáció. Attól függően, hogy az anyagnak mekkora része ment át légnemű állapotba, a térfogata nagy mértékben, arányosan növekszik (az ábrán: solid-vapor). A hármaspont hőmérséklete alatt a légnemű halmazállapotot gőznek nevezzük.
Triple Line
„Hármas vonal” – a magyar szakirodalom ezt a kifejezést nem használja, itt is csak tükörfordítása szerepel. Történeti előzménye a fázisdiagram, amely síkban ábrázolja a nyomás és a hőmérséklet adatait. A termodinamika számára viszont lényegessé vált annak a harmadik állapotjelzőnek a feltüntetése, amely az egyesített gáztörvény lényegi része: .
Ha ezt (a térfogatot) is tekintetbe vesszük, kiderül, hogy a hármaspont egyenessé bomlik, hiszen azonos nyomáson az anyag lehet akár szilárd, cseppfolyós és légnemű is, sőt: ezek elegye is. A vonal legkisebb térfogatú pontja általában a szilárd halmazállapot, legnagyobb térfogatú pontja a légnemű állapot. Halmazállapot változás közben (például szublimáció közben) az anyag folyamatosan növeli a térfogatát; a térfogat akár az ezerszeresére is növekedhet.
Ha a nyomást és a hőmérsékletet állapotjelzőként vesszük tekintetbe, intenzívként, akkor a térfogat számára is intenzív mennyiséget kell találnunk, amely független az anyagi mennyiségtől. Erre a célra két mennyiség áll rendelkezésünkre: a fajlagos térfogat (a térfogat és a tömeg hányadosa), illetve a moláris térfogat (a térfogat és az anyagmennyiség hányadosa). Moláris térfogatként itt most nem az ideális gáz elméleti térfogatát vesszük figyelembe, hanem az anyag aktuális, valóságos térfogatát.
Míg a hőmérséklet és a nyomás megadása meghatározatlan, a p V T (nyomás–térfogat–hőmérséklet) térben a termodinamikai állapot megadása egyértelmű és félreérthetetlen, még fázisátalakulások esetén is.
| Fajlagos és moláris térfogat a hármasponton | ||
| a víz adataival | m³/kg | m³/mol |
| szilárd | 0,0010908 | 1,965·10−5 |
| cseppfolyós | 0,001000 | 1,802·10−5 |
| légnemű | 205,9860 | 3,71090 |
| ideális gáz[* 1] | 205,9763 | 3,71072 |
Remove ads
Metrológiai fontossága
A hármaspont vonalának tulajdonságai:
- három jellemző pontja van: a szilárd, a cseppfolyós és a légnemű anyag fajlagos térfogata;
- a középső pont a folyadékállapot alsó határát jelöli ki;
- hőmérséklete csak egyetlen érték lehet, ettől bármilyen eltérés azt eredményezi, hogy a három halmazállapot valamelyike eltűnik;
- nem jósolható meg, hogy az anyagnak mekkora részaránya van szilárd, cseppfolyós, vagy légnemű állapotban; ezek mindegyike előfordul valamekkora mértékben. Tekintettel arra, hogy valamennyi fázisnak azonos a hőmérséklete, nincs hőáram, amely akár fagyást, olvadást, párolgást, vagy kondenzációt idézne elő.
Ezek a tulajdonságok teszik fontossá a hármaspont meghatározó készülékeket. Ezek közül legfontosabb a kelvin mértékegység kísérleti elrendezéssel történő definíciója: készülék, amelyben a víz mindhárom halmazállapotban jelen van (triple point cell),[12][13] hasonló szerepű, mint a gallium olvadáspont készülék.[14] Gallium hármaspont-meghatározó készülék működik a NIST-nél.[15]
Az Egyesült Királyság központi fizikai laboratóriumában (National Physical Laboratory) a higany hármaspont-meghatározó készülék mérési bizonytalansága 0,2 mK.[16] A mérés időtartama hat óra. Az Egyesült Államok mérésügyének hivatalos szerve, az American Society for Testing and Materials[17] a mintaelőkészítés módjától függően 0,05 mK mérési bizonytalanságot kínál. A NIST, illetve elődje, az amerikai Szabványügyi Hivatal, az NBS[18] oxigén hármaspont-meghatározó készüléket fejlesztett ki. A francia mérésügy jó eredményekkel végez méréseket a széndioxid hármaspont-meghatározó készülékkel.[19] A Pond Engineering argon hármaspont-meghatározó készülékének mérési bizonytalansága 0,5 mK.[20]
A víz hármaspontja
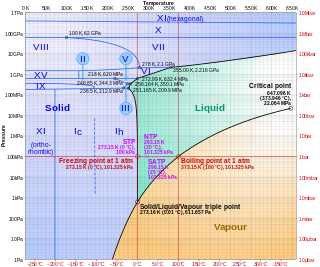
A víz hármaspontján a szilárd fázis Ih hexagonális kristályszerkezetű (az ábrán látható az Ic köbös változat is). Ennek fagyáspontja a hármasponton 0,01 °C, az atmoszferikus nyomáson 0 °C. Minimális fagyáspontja −21,965 °C, ahol JégIII tetragonális kristályszerkezetbe megy át. Jól megfigyelhető az ábrán, hogy a víz (hasonlóan más közegekhez) lehet szilárd halmazállapotú még a kritikus pont felett is. A víz esetén JégVII 15 GPa felett, JégX 62 GPa felett, és JégXI 500 GPa felett. A fázisátmenetek természetesen térfogatváltozással és hőközléssel járnak (izobár entrópiaváltozásként szokták számítani).[21]
A kritikus nyomás felett a szupersűrű folyadék helyezkedik el. Ha a nyomás is és a hőmérséklet is a kritikus pont felett van, az a szuperkritikus állapot tartománya.
A szuperkritikus víz
A víz 373 °C hőmérséklet és 220,6 bar nyomás fölött „szuperkritikussá” válik. Efölött a kritikus pont fölött nem nevezhető sem szilárdnak, sem folyadéknak, de gáz állapotúnak sem, leginkább „folyadékszerű gáz”-ként írható le. Ha a szuperkritikus víz szerves anyaggal érintkezik, felszakítja annak kémiai kötéseit, majd oxigén hatására reakció megy végbe, vagyis az anyag elég. Ez általában lángok nélkül történik. A reakció végén szén-dioxid és tiszta víz keletkezik, a más égések során keletkező káros melléktermékek nélkül.[22]
A folyamat jelentőségét az adja, hogy felhasználható szerves hulladékok, vagy szerves anyagokat is tartalmazó hulladékok, például szennyvíz környezetbarát megsemmisítésére.
A szuperkritikus víz tulajdonságainak vizsgálatával a Nemzetközi Űrállomás űrhajósai is foglalkoznak a japán kísérleti modulban (JEM). A francia űrügynökség, a CNES által kifejlesztett DECLIC nevű berendezés alkalmas a folyamat vizsgálatára mikrogravitációs környezetben (a gravitáció kiiktatásával a folyamat könnyebben kivitelezhető). Az egyetlen hátránya a folyamatnak, hogy a vízben lévő oldott sók könnyen kicsapódnak, amik a vízzel érintkező fémalkatrészek rozsdásodását okozzák.
A kísérletek az ISS-en 2013 júliusában kezdődtek, amiket nagyjából 2015 januárjáig terveztek befejezni.
Az Amerikai Haditengerészet néhány hadihajóját már felszerelte ilyen kísérleti berendezéssel, amit a gyakorlatban is használnak. Orlando városa szuperkritikus víz felhasználásával működő szennyvíztisztító építésébe kezdett (2014).[22][23]
Remove ads
Hármaspontok táblázata
A táblázat a három halmazállapot (szilárd, cseppfolyós, légnemű) érintkezési pontjának adatait tartalmazza. Az adatok legtöbbje a NIST Chemistry Webbook,[24] illetve jogelődje, az amerikai Szabványügyi Hivatal (National Bureau of Standards) közleményeiből származnak.[25]
Remove ads
Megjegyzések
- Nem atmoszférikus, hanem 611 Pa nyomáson
Források
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


