Timeline
Chat
Prospettiva
Solfuro di carbonio
composto chimico organico Da Wikipedia, l'enciclopedia libera
Remove ads
Il solfuro di carbonio (nome sistematico: disolfuro di carbonio) è un composto binario del carbonio tetravalente con lo zolfo, avente formula molecolare CS2. È impiegato in chimica organica come utile intermedio di sintesi e usato spesso come solvente.[2]
La sua molecola è isoelettronica di valenza con l'anidride carbonica e, in analogia a quest'ultima, CS2 è considerato la tioanidride dell'acido tritiocarbonico H2CS3,[3][4] composto instabile al pari dell'acido carbonico H2CO3,[5] e dal quale derivano formalmente i corrispondenti tiosali,[6] o solfosali.[7]
Il solfuro di carbonio, l'anidride carbonica e il solfuro di carbonile (COS), data la loro struttura molecolare con due doppi legami cumulati (=C=), sono considerati far parte degli eteroalleni.[8]
Del CS2 sono noti anche gli analoghi con il selenio (CSe2, liquido giallo, p. eb. 125,5 °C[9]) e con il tellurio (CTe2, liquido[10]), tutti isoelettronici di valenza, che però sono via via più instabili, nonché i composti misti CSSe (liquido giallo, p. eb. 84,5 °C[11]) e CSTe.[3][12]
Il CS2 non va confuso con il monosolfuro di carbonio CS,[13] formalmente analogo al monossido di carbonio CO, che è una molecola ottenibile per fotolisi di CS2 e nota in fase gassosa ma che polimerizza se fatta condensare allo stato liquido o solido.[14]
Il solfuro di carbonio è un composto irritante e tossico a causa della sua interazione con il sistema nervoso centrale, come pure COS,[15] e nocivo alla riproduzione.[16]
Remove ads
Proprietà
Riepilogo
Prospettiva
A temperatura ambiente il solfuro di carbonio si presenta come un liquido mobile, incolore, più pesante dell'acqua (d = 1,266 a 25 °C), molto volatile (Teb. = 46,25 °C)[17] e fortemente infiammabile: brucia con fiamma bianco-azzurra poco luminosa, pressoché invisibile di giorno e meno luminosa e meno alta di quella della benzina in condizioni comparabili.[18] Il suo vapore è 2,63 volte più pesante dell'aria e può formare con essa miscele esplosive.[17]
Il solfuro di carbonio ha un odore etereo piacevole[16] che ricorda in parte quello dolce del cloroformio.[19][20] Al contrario, in campioni commerciali non purissimi, specie se il liquido appare giallino, presenta un caratteristico odore sgradevole.[19]
Il solfuro di carbonio è fotosensibile e va conservato in recipienti metallici o bottiglie scure, perché l'esposizione alla luce causa una parziale decomposizione con la formazione di una colorazione gialla e la comparsa dell'odore sgradevole.[15]
Polarità e solubilità
Il solfuro di carbonio è un composto apolare, pochissimo solubile in acqua, 2,9 g/L, ≈ 0,038 M (20 °C)[21] e con costante dielettrica molto bassa: εr = 2,64;[22] tuttavia, è un ottimo solvente, particolarmente apprezzato per cere, grassi, idrocarburi e sostanze non polari in genere;[23] è inoltre il migliore conosciuto per elementi puri, quali zolfo elementare, 35,5 g/100 g (≈ 11,07 mol/kg) e fosforo bianco (P4), 89 g/100 g (≈ 28,73 mol/kg)[24] ed è inoltre un buon solvente anche per il selenio, il bromo e lo iodio.[25]
Il solfuro di carbonio è solubile in ogni rapporto con il tetracloruro di carbonio, il benzene, il cloroformio, l'etere di petrolio, l'etere, l'alcool assoluto e l'anidride solforosa liquida; è molto solubile nel metanolo (87,2 g/100 g), come pure in dimetilsolfossido (45 g/100 g) ed è solubile pure nel tricloruro di fosforile, mentre è praticamente insolubile in solfolano.[26]
Proprietà termodinamiche
Il solfuro di carbonio è un composto endotermico: ΔHƒ° = +89,41 ± 0,71 kJ/mol;[27] questo a marcata differenza da CO2, che invece è un composto fortemente esotermico (ΔHƒ° = -393,51 ± 0,13 kJ/mol);[28] per completezza, il composto misto COS (solfuro di carbonile, gassoso) è esotermico, con valore intermedio (ΔHƒ° = -138,41 kJ/mol).[29] Questo vuol dire che i legami del carbonio con gli eteroatomi, passando da O a S, si indeboliscono notevolmente, rendendo la molecola CS2 parecchio più reattiva di CO2.[16]
Struttura elettronica e molecolare
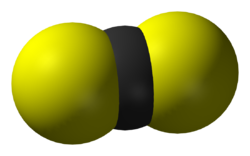
La molecola del solfuro di carbonio ha formula di struttura S=C=S, è lineare con simmetria D∞h,[30] come quella analoga dell'anidride carbonica (O=C=O). Tuttavia, data la differenza di elettronegatività molto piccola tra zolfo (χ = 2,58) e carbonio (χ = 2,55), i legami C=S sono solo marginalmente polari, a differenza dei legami C=O, che invece sono molto polari [χ(O) = 3,44].[31]
Come in CO2, l'atomo centrale C è è ibridato sp[32][33] e qui forma due doppi legami con due atomi di zolfo, uno da una parte e uno dall'altra; l'angolo di legame è ovviamente di 180° e di conseguenza il momento dipolare è nullo per simmetria, come in CO2.[30]
La distanza C–S dedotta da indagini diffrattometriche è di 155,80 ± 0,05 pm,[34] un valore apprezzabilmente minore rispetto al valore normale (160 pm) per un legame C=S con C ibrido sp2,[35] confrontabile con la distanza C–S nel solfuro di carbonile, che è di 156,28 ± 0,10 pm;[36] distanze che però sono comunque notevolmente maggiori di quella C–O nella CO2 (116,2 pm), come atteso per la differenza tra i raggi covalenti di S (terzo periodo) e O (secondo periodo).[37]
Chimica ionica in fase gassosa
Il potenziale di ionizzazione del solfuro di carbonio, pari a 10,07 eV,[38] è leggermente minore di quello di COS (11,18 eV),[39] ma alquanto minore rispetto a quello di CO2 (13,78 eV).[40]
L'affinità elettronica di CS2, pari a 0,55 eV,[38] è leggermente maggiore di quella di COS (0,46 eV),[39] mentre quella di CO2 è negativa (≈ −0,6 eV).[40]
La molecola CS2 ha un'affinità protonica di 681,9 kJ/mol,[38] un po' più grande rispetto a COS ( 628,5 kJ/mol),[39] ma molto maggiore di quella della CO2 (540,5 kJ/mol)[40] e in ogni caso di poco inferiore rispetto a H2O (691 kJ/mol),[41] la quale risulta quindi più basica in fase gassosa di tutte e tre le specie.
CS2 può fungere da acido di Lewis catturando uno ione fluoruro esotermicamente, con rilascio di 146 kJ/mol, ma molto di meno per la cattura di uno ione cloruro (36,8 kJ/mol), bromuro (34,7 kJ/mol) o ioduro (31 kJ/mol),[42] che sono basi di Lewis molto più deboli.
Remove ads
Presenza in natura e produzione
Riepilogo
Prospettiva
Piccole quantità di solfuro di carbonio vengono liberate dalle eruzioni vulcaniche e dalle paludi.[2]
Il CS2 veniva prodotto per sintesi diretta da carbonio (o coke) e zolfo (C + 2 S → CS2) a temperature elevate (800-1.000 °C).[43] Una reazione a temperatura più bassa (600 °C e in presenza di gel di silice o allumina come catalizzatori) utilizza invece il metano del gas naturale come fonte di carbonio:[44]
La reazione è analoga alla reazione di combustione del metano in ossigeno a dare CO2 e H2O.
L'arrostimento del tiocianato mercurico produce, in aggiunta al solfuro mercurico e tetranitruro di tricarbonio, vapore di solfuro di carbonio:[45]
2 Hg(SCN)2 (s) → 2 HgS (s) + C3N4 (s) + CS2 (g) ↑
Remove ads
Reazioni
Riepilogo
Prospettiva
Il solfuro di carbonio è altamente infiammabile e brucia all'aria formando anidride carbonica e anidride solforosa:
Il solfuro di carbonio, sottoposto a scariche elettriche, produce il disolfuro di tricarbonio C3S2 (S=C=C=C=S), che è un liquido rosso (p. fus. ≈ -5 °C), instabile, che lentamente polimerizza a temperatura ambiente; questo è analogo al sottossido di carbonio C3O2.[12]
Reagisce con un eccesso di cloro formando il tetracloruro di carbonio:[47]
CS2 + 3 Cl2 → CCl4 + S2Cl2
Il solfuro di carbonio reagisce con l'anidride solforica dando solfuro di carbonile e anidride solforosa:[15]
CS2 + 3 SO3 → COS + 4 SO2
Qui i tre atomi S di SO3 si riducono nel formare 3 SO2 (+6 → +4) e uno dei due atomi S di CS2 si ossida a formare SO2 (-2 → +4).
Rispetto alla CO2, CS2 è più reattivo verso i nucleofili (ammine primarie e secondarie), SH−, OR− e dando prodotti termodinamicamente favoriti e facilmente isolabili.[48]
Con le ammine si ottengono i rispettivi ditiocarbammati:[49]
CS2 + R2NH → [R2NH2]+[R2N-CS2]−
Con gli alcossidi si ottengono i rispettivi xantati:[50]
CS2 + RO− → RO-CS2−
La reazione con ioni solfuro (solfuri alcalini) fa apprezzare la natura di tioanidride di CS2, nonché la sua acidità di Lewis, producendo i corrispondenti tiosali, in questi casi i tritiocarbonati:[49]
CS2 + Na2S → Na2CS3
La reazione con nucleofili potenti come gli alogenuri di alchilmagnesio (reattivi di Grignard) è interessante anche perché costituisce una via di sintesi degli acidi ditiocarbossilici. In tal modo, ad esempio, il solfuro di carbonio reagisce con il cloruro di metilmagnesio in soluzione eterea per dare il sale dell'acido ditioacetico; il successivo trattamento a freddo con acidi minerali diluiti fornisce il corrispondente acido, piuttosto instabile:[51]
CS2 + CH3MgCl → CH3C(=S)S−MgCl
CH3C(=S)S−MgCl + HCl → CH3C(=S)SH + MgCl2
Il solfuro di carbonio reagisce con il fluoruro di argento in acetonitrile a caldo per dare il sale di argento del trifluorotiometanolo:[52]
CS2 + 3 AgF → CF3SAg + Ag2S
Riscaldato e sottoposto ad alte pressioni, il solfuro di carbonio polimerizza per dare un solido nero.[47] Queste differenze di reattività possono essere attribuite alla minore forza dei legami C-S rispetto a quelli C-O, che rende il carbonio di CS2 più facilmente attaccabile, rendendo di fatto il C di CS2 più elettrofilo di quello di CO2, nonostante i legami C=S siano molto meno polari di quelli C=O.
Il solfuro di carbonio trova ampio uso nella sintesi di composti organo-zolfo (quali ad esempio gli xantati ROCS2− e il metham sodico, un fumigante per suolo) e viene comunemente utilizzato nella produzione del tessuto di viscosa.
Remove ads
Igiene industriale
L'esposizione a solfuro di carbonio determina il solfocarbonismo, una grave malattia che nel passato assunse un'importante rilevanza sociale dovuta all'ampiezza dei dati epidemiologici. In Italia fu una delle prime malattie professionali riconosciute dall'INAIL.
Note
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads






![{\displaystyle {2\,\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}\mathrm {S} {\vphantom {A}}_{\smash[{t}]{8}}{}\mathrel {\longrightarrow } {}2\,\mathrm {CS} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}4\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {S} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/5773a441e21d3d2eeb736c5e51450e0ba353692c)
![{\displaystyle {\mathrm {CS} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/4e55a3729649f78bb197c02c67208bd2a66069f1)