Timeline
Chat
Prospettiva
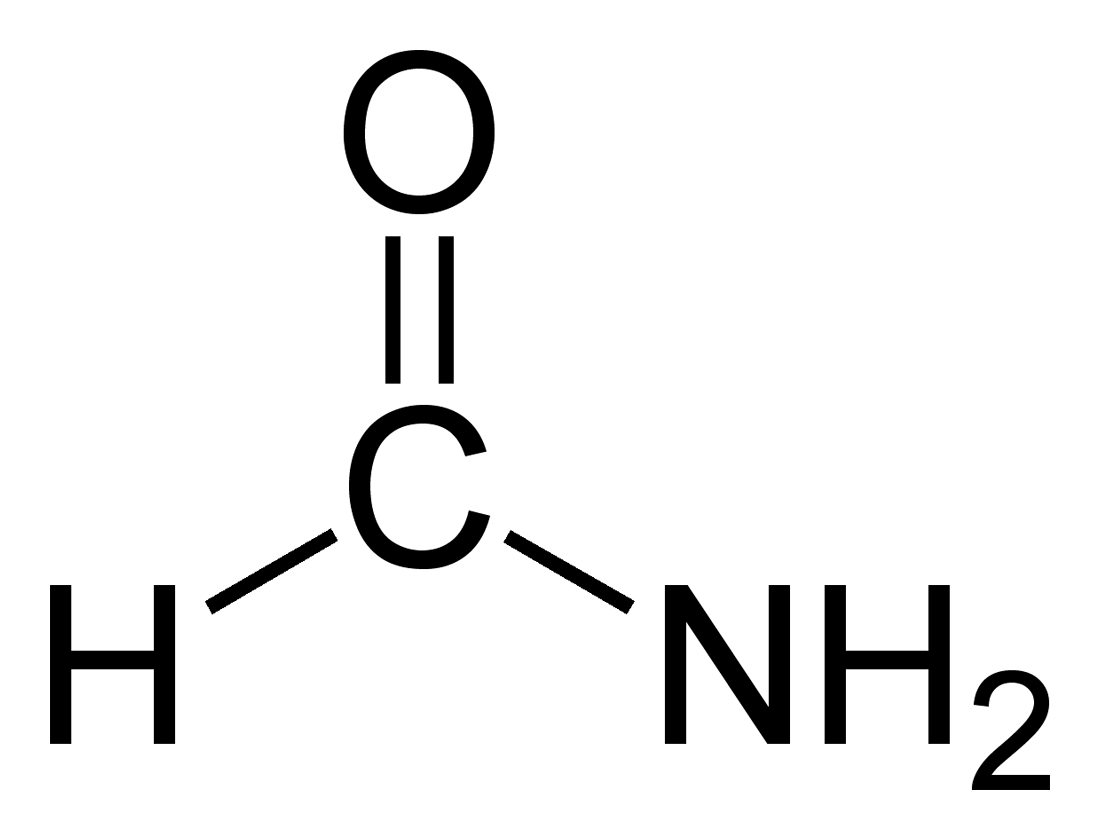
Formammide
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
La formammide[2] o metanammide (nome sistematico) è l'ammide dell'acido formico ed è la più semplice delle ammidi degli acidi carbossilici (carbossammidi); la sua formula molecolare è H-C(=O)–NH2, di solito scritta semplicemente HCONH2,[3] e da questa derivano le formammidi sostituite H-C(=O)–NRR'.
Come tutte le ammidi, è soggetta ad un equilibrio tautomerico che produce l'acido formimmidico,[4] H-C(=NH)–OH,[5] che però è molto meno stabile ed è quindi presente all'equilibrio in quantità molto piccole; l'acido formico catalizza la conversione tra i due.[6]
La molecola della formammide è presente in vari ambienti nell'Universo: nel mezzo interstellare, nel nucleo della Via Lattea (Sagittario A*) ed è stata trovata anche in qualche cometa (Hale-Bopp e Hyakutake).[7]
La formammide è un isomero strutturale della formaldossima (H2C=N−OH), anch'essa presente in mezzi interstellari.[8]
Remove ads
Caratteristiche
A temperatura ambiente la formammide si presenta come un liquido incolore di consistenza oleosa, igroscopico e altobollente, leggermente più denso dell'acqua e completamente miscibile con essa;[9] è completamente solubile anche in altri solventi polari, come l'alcol etilico e il solfolano,[10] come pure in alcol metilico, diossano, acido acetico, glicol etilenico e glicerina,[11] mentre è pochissimo solubile in benzene.[10]
La formammide è inodore se pura,[12] ma spesso esibisce un odore molto lieve di ammoniaca.[4] Pur essendo una sostanza combustibile, è difficilmente infiammabile.[9]
La formammide è l'unica carbossammide liquida a temperatura ambiente: le altre, a partire dall'acetammide, sono solidi cristallini.[13]
Remove ads
Struttura molecolare e proprietà
Riepilogo
Prospettiva
La formammide è un composto molto stabile termodinamicamente: ΔHƒ° = -251 kJ/mol in fase liquida a 25 °C.[14] La molecola è un ibrido di risonanza tra due forme limite:
- H-C(=O)–NH2 ←→ H-C(O–)=+NH2
Nell'ibrido la seconda forma è meno favorita della prima per la presenza in essa della separazione di carica,[15] anche se di tipo favorevole, ma comunque questa forma è presente e contribuisce all'ibrido di risonanza (molecola reale); questo implica che, oltre che, per poter fare un legame π, gli atomi C e O, ma anche l'atomo N, siano ibridati sp2. Quindi, in base a queste considerazioni, la molecola è prevista essere planare.
Un'indagine spettroscopica rotazionale nella regione delle microonde ha assunto una struttura essenzialmente planare ed in base a questa ipotesi ha fornito, tra l'altro, i parametri strutturali della molecola, alcuni dei quali sono i seguenti:[16][17]
r(C–H)) = 109,8 pm; r(C–O) = 121,9 pm; r(C–N) = 135,2 pm; r(N–Hcis, trans) = 100,15 pm;
∠(H-C-O) = 122,5°; ∠(H-C-N) = 112,7°; ∠(N-C-O) = 112,7°; ∠(cisH-N-C) = 118,5°; ∠(transH-N-C) = 120°.
Da un'indagine di diffrazione elettronica in fase gassosa appena successiva sono stati ricavati parametri strutturali sufficientemente simili.[18] Si può notare che il legame C–N è decisamente più corto del normale per un legame semplice (147 pm[19]) e che il legame C=O è lievemente più lungo che nella formaldeide H2C=O (120,8 pm[20]), dove quella risonanza coinvolgente la coppia solitaria dell'atomo di azoto non c'è, cosa questa che si accorda qualitativamente con la presenza della risonanza vista sopra.
Nella struttura ricavata allo stato solido tramite cristallografia a raggi X, dove si osserva la presenza di dimeri planari della formammide, si nota un legame C=O più lungo (125,5 pm), rispetto alla fase gassosa, e un legame C–N più corto (130,0 pm).[21]
La molecola della formammide risulta essere molto polare (μ = 3,71 D; per l'acqua, μ = 1,86 D)[22] ed è capace di essere donatrice di due legami idrogeno (con il gruppo –NH2) e di poter riceverne tre, due sull'ossigeno carbonilico e uno sull'atomo di azoto ammidico. Inoltre, la formammide liquida ha un'alta costante dielettrica: εr = 111 a 20 °C, ben superiore a quella dell'acqua (εr = 80,1 a 20 °C).[23]
L'alta polarità della molecola, la sua capacità di fare legami idrogeno e l'alta costante dielettrica ne fanno un buon solvente protico non acquoso, che può sciogliere diversi composti ionici, anche alcuni poco solubili in acqua;[24] è un buon solvente anche per gli zuccheri e a volte si mostra un solvente anche migliore dell'acqua stessa per i polisaccaridi,[25] come per il caso del destrano[26] e dell'amilosio.[27]
Il suo derivato dimetilsostituito sull'azoto, la N,N-dimetilformammide (DMF), è invece un comune solvente polare aprotico, utilmente impiegato nelle sostituzioni nucleofile SN2 e in vari casi in cui occorra solvatare bene specie cationiche, ma molto meno quelle anioniche.[28]
Proprietà acido-base
In acqua non si comporta apprezzabilmente come acido o come base. Il suo pKa in dimetilsolfossido è 23,5,[29] contro il valore di 25,5 per l'acetammide,[30] che quindi è notevolmente meno acida. Il pKa in soluzione acquosa è stimato in 16,50±0,50. La forma protonata H-C(=O+–H)–NH2, che è un importante intermedio nelle reazioni di idrolisi acido-catalizzate della formammide, ha pKa ≈ -2 in ambiente acquoso.[31]
L'affinità protonica della formammide, che è una misura della sua basicità intrinseca e che coinvolge ovviamente la stessa specie protonata, ma in fase gassosa, ammonta a 822,2 kJ/mol,[32] contro 863,6 kJ/mol dell'acetammide, che quindi è una molecola parecchio più basica.[33]
Remove ads
Produzione ed applicazioni
Riepilogo
Prospettiva
La formammide veniva storicamente prodotta per reazione dell'acido formico con l'ammoniaca per formare inizialmente formiato di ammonio; questo, per riscaldamento, elimina una molecola di acqua, dando così la formammide:[34][35]
- H-COOH + NH3 → H-COO− NH+4
- H-COO− NH+4 → H-CONH2 + H2O
A livello industriale viene sintetizzato per reazione diretta tra ammoniaca ed ossido di carbonio (una reazione di carbonilazione):[36]
- CO + NH3 → H-CONH2
In alternativa, si può sfruttare l'ammonolisi[37] del formiato di metile, il quale è prodotto a sua volta tramite la carbonilazione del metanolo:
- CO + CH3OH → H-COOCH3
- H-COOCH3 + NH3 → H-CONH2 + CH3OH
Il metanolo che si produce può poi ritornare ad essere impiegato nel primo stadio.
Trova impiego come intermedio nella sintesi di farmaci e di prodotti per l'agricoltura (erbicidi, pesticidi, ecc.). È un composto tossico per la riproduzione (teratogeno).
Viene anche usato in chimica organica come composto riducente.[38] Ad esempio, è capace di convertire l'acido urico (2,4,8-triossi-purina) nel suo precursore xantina (2,4-diossi-purina) secondo la seguente reazione:
- urato + formamide = xantina + anidride carbonica + ammoniaca.
Il suo dimetil-derivato N,N-dimetilformammide è uno dei solventi polari di maggior uso nella chimica organica. È un composto capace di rompere anche forti legami idrogeno, come quelli della cellulosa.
Note
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads