トップQs
タイムライン
チャット
視点
トロポロン
ウィキペディアから
Remove ads
α-トロポロン(英: α-tropolone) 、または単にトロポロンとは、分子式C
7H
5(OH)Oで表わされる有機化合物である。淡黄色を呈する固体であり、有機溶媒によくとける。その特異な電子状態への興味や配位子前駆体としての役割から研究されている。実際の合成時にトロポンを出発物質とすることはほとんどないが、トロポンの2位にヒドロキシ基が導入された誘導体とみなすことができる。
この項目「トロポロン」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Tropolone) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2024年3月) |
Remove ads
合成法
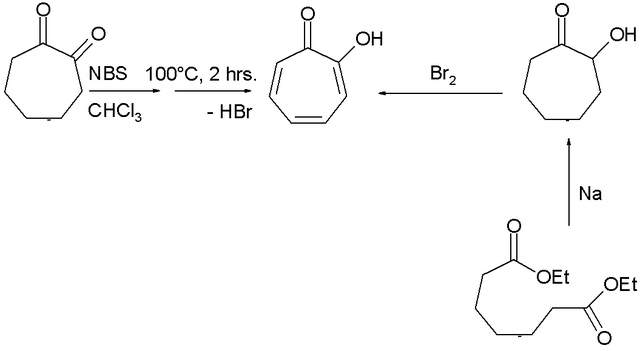
トロポロンの合成法は数多くのものが開発されている[3]。その1つとして、1,2-シクロヘプタジオンをN-ブロモスクシンイミドにより臭素化したのち、加熱して脱ハロゲン化水素する方法があげられる(下図左の経路)。もうひとつは、 ピメリン酸のエチルエステルからアシロイン縮合により得られるアシロインを臭素により酸化する方法があげられる(下図右経路)[4]。
さらに別の経路として、シクロペンタジエンとケテンの一種とを[2+2] 環化付加反応させビシクロ[3.2.0]ヘプチル構造を得たのち、 加水分解により結合を解離させて単環化する方法もある[3]。
性質
トロポロンのヒドロキシ基は酸性を示し、pKa の値は7である。この値はフェノール(10)と安息香酸(4)の中間に位置する。フェノールにくらべ酸性が強い理由は、カルボニル基がビニローグ的カルボン酸構造との共鳴安定化をうけるためと説明される[4]。
トロポロンは容易にO-アルキル化を受け、シクロヘプタトリエニル誘導体を生じるため、合成中間体として有用である[5] 。金属カチオン存在下では脱プロトン化されて2座配位子となり、Cu(O
2C
7H
5)
2のような錯体を生じる[4]。
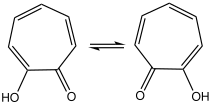
多くのトロポン類と同様、トロポロンのカルボニル基は強く分極しており、ヒドロキシ基との間に強い水素結合を生じるため、溶液中では高速な互変異性化反応を起こしており、NMRのタイムスケールでは対称な構造に見える[6]。固体状態でも速度は遅くなるが互変異性化する[7]。
自然界での分布
およそ200ほどのトロポロン誘導体が自然に得られており、主に植物および菌類により産生される[8]。トロポロン誘導体としては、ドラブリン、ドラブリノール、ツヤプリシン、ツヤプリシノール、スチピタト酸、スチピタトン酸、ノオトカチン、ノオトカチノール、プベルル酸、プベルロン酸、セペドニン、4-アセチルトロポン、pygmaein, isopygmaein, procein, カノーチン、ベンゾトロポロン類、(プルプロガリン、クロシポジン、グピオロン A および B)、テアフラビンおよびその誘導体、ブロモトロポロン類、トロポイソキノリン類、トロポロイソキノリン類(grandirubrine, イメルブリン、イソイメルブリン、パレイトロポン, パレイルブリン AおよびB)、コルヒチン、コルヒコンなどが知られる[9]。トロポロンはポリケチド経路にあらわれ、フェノール系中間体から環拡張により得られる[5]。
ヒノキ科やユリ科の植物種に特によくみられる[8]。トロポロン類がもっとも多量に見られるのは心材部、葉部、樹皮部であり、その精油には様々なトロポロン類が豊富に含まれる。自然界でトロポロン誘導体が研究・単離されはじめたのは1930年代中期から1940年代初頭にかけてで[10] 、アメリカネズコ、アスナロ、ヒノキ、タイワンヒノキ、スペインビャクシンなどの樹木から同定された。初めて合成されたトロポロン類はツヤプリシンで、Ralph Raphaelにより合成された[11]。
生活性
トロポロン誘導体
Remove ads
出典
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads