トップQs
タイムライン
チャット
視点
ヘム
2価の鉄原子とポルフィリンから成る錯体 ウィキペディアから
Remove ads
ヘム(英語: haem、アメリカ英語: heme 英語: [ˈhiːm], [ˈhɪm]、ドイツ語: Häm)は、2価の鉄原子とポルフィリンから成る錯体である。通常、2価の鉄とプロトポルフィリンIXからなるプロトヘムであるフェロヘムのことをさすことが多い。ヘモグロビン、ミオグロビン、ミトコンドリアの電子伝達系(シトクロム)、薬物代謝酵素(P450)、カタラーゼ、一酸化窒素合成酵素、ペルオキシダーゼなどのヘムタンパク質の補欠分子族として構成する。ヘモグロビンは、ヘムとグロビンから成る。ヘムの鉄原子が酸素分子と結合することで、ヘモグロビンは酸素を運搬している。

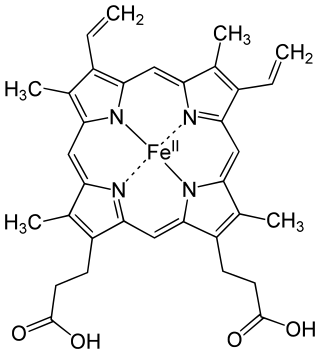
フェリヘムやヘモクロム、ヘミンなど、その他のポルフィリンの鉄錯体もヘムと総称されることもある。
なお、「ヘム」という名称の由来は、古代ギリシア語の αἷμα(haîma「血」)である。
Remove ads
生合成
要約
視点
ヘムは以下のように8段階の反応によって生合成される。
第1段階

ポルフィリンとヘムの生合成の律速酵素は、グリシンとスクシニルCoAがδ-アミノレブリン酸へ縮合することを媒介するアミノレブリン酸シンターゼ(アミノレブリン酸合成酵素)(Aminolevulinic acid synthase)(EC 2.3.1.37)である。アミノレブリン酸シンターゼは、ミトコンドリア内に所在する。ヘム合成の第1段階の反応である[1]。ヒトにおいてはアミノレブリン酸シンターゼの転写は、鉄と結合していないポルフィリン中間体の蓄積を防ぐために、ポルフィリンとの結合要素であるFe2+の存在の有無によって厳密に管理されている。体内には2種類のアミノレブリン酸シンターゼが存在する。1つは、赤血球前駆細胞で発現し、もう1つは全身で発現するものである。赤血球の形成は、X染色体上の遺伝子に記述されているが、もう1つは3染色体の遺伝子上に記述されている。X染色体に関連した鉄芽球性貧血は、X染色体上のアミノレブリン酸シンターゼの遺伝子の変異によって起こるが、もう1つの遺伝子の変異は何の疾患も発生させない。

第2段階
ミトコンドリアから細胞質に移行したδ-アミノレブリン酸2分子が細胞質に所在するアミノレブリン酸脱水酵素によって脱水縮合されると、ピロール環構造を持つポルフォビリノーゲン(PBG)となる。
δ-アミノレブリン酸2分子 ポルフォビリノーゲン(PBG)
第3段階
細胞質においてポルフォビリノーゲン4分子がポルフォビリノーゲン脱アミノ酵素(別名:ヒドロキシメチルビラン合成酵素)によってアンモニアを脱離して結合すると、ピロールが4つ直線状に連結した構造をもつヒドロキシメチルビランが出来る。
4 + H2O ⇒ + 4 NH3 ポルフォビリノーゲン ヒドロキシメチルビラン
第4段階
ヘム合成回路において細胞質においてヒドロキシメチルビランがウロポルフィリノーゲンIIIシンターゼによって縮合し、環を巻くとウロポルフィリノーゲンIIIとなる。この際、ウロポルフィリノーゲンIIIシンターゼの働きにより4つのピロール環が整然と並んだヒドロキシメチルビランの一端のピロール環一つだけが反転して縮合し環を形成する。ウロポルフィリノーゲンIIIシンターゼが働かない場合、ピロール環が整然と並んだままのヒドロキシメチルビランが自発的に縮環してウロポルフィリノーゲンI が生成する。ウロポルフィリノーゲンI はウロポルフィリノーゲン脱炭酸酵素の基質となりコプロポルフィリノーゲンIへと変換されるが、これはコプロポルフィリノーゲン酸化酵素の基質とならないため、プロトポルフィリンには至らない[2]。 このようにウロポルフィリノーゲンI やコプロポルフィリノーゲンIが蓄積していくことがポルフィリン症の原因の1つとなりうる。
⇒ ヒドロキシメチルビラン ウロポルフィリノーゲンIII
ウロポルフィリノーゲンI
第5段階
細胞質においてウロポルフィリノーゲンIIIが、ウロポルフィリノーゲン脱炭酸酵素によって4つの酢酸基が脱炭酸されてメチル基となったものがコプロポルフィリノーゲンIIIである。
---> + 4 CO2 ウロポルフィリノーゲンIII コプロポルフィリノーゲンIII
第6段階
さらに、細胞質に所在したコプロポルフィリノーゲンIIIがミトコンドリア内に移行し、コプロポルフィリノーゲン酸化酵素によって2箇所のプロピオン酸基が酸化され、ビニル基に変換されるとプロトポルフィリノーゲンIX となる[1]。
---> コプロポルフィリノーゲンIII プロトポルフィリノーゲンIX
第7段階
最終的にプロトポルフィリノーゲン酸化酵素によって酸化されると、共役したポルフィリン環が形成され、プロトポルフィリンIX ができあがる。
---> プロトポルフィリノーゲンIX プロトポルフィリンIX
第8段階
鉄付加酵素によりプロトポルフィリンIXに鉄が配位したものがヘムである。この反応はミトコンドリア内で進む。ミトコンドリア内で生成されたヘムは細胞質に出て対応するアポタンパク質と結合してヘムタンパク質となる[1]。
+ Fe2+ ⇔ + 2H+ プロトポルフィリンIX ヘム
ヘム生合成の8段階の反応と関連事項
Remove ads
分解
要約
視点
ヘムの分解は、脾臓中のマクロファージによって開始される。このマクロファージは、循環中の古くなったり損傷を受けた赤血球を取り除く。最初の段階で、ヘムは、ヘムオキシゲナーゼ(HMOX)によりビリベルジンに分解される。NADPHが還元剤として使われ、酸素分子が反応に加わり、一酸化炭素(CO)が生成され、鉄がIII価のイオン(Fe3+)としてポルフィリン環から解放される。
遊離ヘムは脂溶性の鉄化合物であることから、活性酸素生成を促進して細胞傷害を悪化させる[3]。例えば、ヘムを含むミオグロビンは筋挫滅や強い圧迫を受けた筋肉が開放されるとカリウム、乳酸などとともに大量に流れ出し、クラッシュ症候群を引き起こし、急性腎不全を引き起こす。ミオグロビンやヘモグロビンのヘム色素は急性尿細管壊死を引き起こし腎不全の原因となる[4]。
ヘム分解は、DNAや脂質を損傷させる有害な酸化ストレスを速やかに解消するための反応で、種の保存のために進化の過程で獲得されたものと考えられる。つまり、細胞が遊離したヘムにより発生したフリーラジカルにさらされると、ヘムを分解代謝するヘムオキシゲナーゼ1が極めて速やかに導入されることとなる(下図参照)。その理由は、細胞は遊離ヘムによる酸化ストレスを迅速に解消するためにヘムを分解する能力を指数的に増加させなければならないからである。これは、遊離ヘムによる悪影響を迅速に回避するための細胞の自衛反応であろう。
HMOX(ヘムオキシゲナーゼ)1/2 ヘム --------------> ビリベルジン + Fe3+ / \ H+ + NADPH NADP+ O2 CO
2番目の反応として、ビリベルジンがビリベルジン還元酵素(BVR)によりビリルビンに還元される。
ビリベルジン還元酵素(BVR) ビリベルジン -----------------> ビリルビン / \ H+ + NADPH NADP+
ビリルビンは、血漿中のアルブミンであるタンパク質と結合して肝臓に運ばれる。肝臓では、ビリルビンがグルクロン酸と結合してより水に溶けやすいものとなる。この反応はUDP-グルクロン酸転移酵素(UDPGUTF)によって媒介される。
ビリルビン + ウリジン二リン酸グルクロン酸------------> ジグルクロン酸ビリルビン \ 2 ウリジル酸(UMP) + 2 リン酸(Pi) ウリジン二リン酸-グルクロン酸転移酵素(UDPGUTF)
この形のビリルビンは肝臓から胆汁として分泌される。腸内細菌は、ジグルクロン酸ビリルビンのグルクロン酸を外し、さらにビリルビンをウロビリノーゲンへと還元させる。ある程度のウロビリノーゲンは、小腸に吸収され、体内で抗酸化作用を示し[5][6]、酸化されると黄色のウロビリンに変化し、腎臓に運ばれ、尿として排泄される。大半のウロビリノーゲンは、大腸を経てウロビリノーゲンの両端のピロール環が還元されて無色のステルコビリノーゲンが生成され、さらにステルコビリノーゲンが酸化されて分子中央のメチレン基が二重結合化して共役して、大便の茶色の元となるステルコビリンが生成されて大便とともに排泄される[7]。
腸内細菌 小腸吸収 酸化 (尿中に排泄) ビリルビン----->ウロビリノーゲン--------->ウロビリン(黄色) 大腸へ 還元 酸化 (大便中に排泄) --------->ステルコビリノーゲン--------->ステルコビリン(茶色)
Remove ads
脚注
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
