トップQs
タイムライン
チャット
視点
配位構造
ウィキペディアから
Remove ads
配位構造(はいいこうぞう、英: coordination geometry)は、化学および固体化学/物理学の分野で多く用いられる用語である。
分子
→詳細は「分子構造」を参照
無機錯体
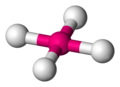
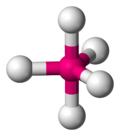
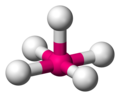
無機錯体の分野では、配位構造とは分子または錯体が中心となる原子に結合することで形成される幾何学的なパターンである。幾何学的配置は、中心原子に結合した配位子の数とタイプに応じて異なるが、中心原子(主に錯体中の金属)の種類による。結合した原子数(または中心原子と配位子間のσ結合の数)は配位数と呼ばれる。幾何学的パターンは、中心原子を中心として、頂点に配位子の原子がくる多面体として説明することができる[1]。
金属の配位傾向はその酸化数によって変化する。配位結合の数(配位数)は2からTh(η5-C5H5)4の20まで変化し得る[2]。
最も一般的な配位構造は、金属に6個の配位子が対称的に配置した八面体形(配位数6)である。その他一般的な配位構造には四面体形(配位数4)や平面四角形(配位数4)がある。
結晶場理論は、配位構造の異なる遷移金属化合物の安定性および常磁性の存在の可否の説明に使われ、原子価殻電子対反発則 (VSEPR) は、典型元素錯体の構造予測に使われる。
Remove ads
結晶学的用法
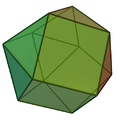
結晶構造内の原子の配位構造は、結合モデルに依存する配位原子の定義に使われる幾何学的パターンである[1]。例えば岩塩中のナトリウムイオンには6個の塩化物イオンが隣接した八面体構造であり、塩化物イオンにも同様に6個のナトリウムイオンが隣接した八面体構造である。体心立方格子構造 (bcc) をとる金属ではそれぞれ8個の原子が隣接した立方体構造である。面心立方格子構造 (fcc) をとる金属ではそれぞれ12個の原子が隣接した立方八面体構造である。
配位構造の一覧
Remove ads
無機化合物の命名
IUPACは、化合物中の原子の周りの構造を説明するためにIUPAC無機化学命名法2005年勧告において多面体シンボルを導入している[6]。
関連項目
- 分子構造
- 原子価殻電子対反発則
- 配位子場理論
- シス効果
- グリーン・デイビス・ミンゴス則
出典
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads