トップQs
タイムライン
チャット
視点
RAF1
ウィキペディアから
Remove ads
RAF1はヒトではRAF1遺伝子にコードされる酵素である[4][5][6]。c-Raf(proto-oncogene c-RAF)という名称が用いられることもあり、他にもRAF proto-oncogene serine/threonine-protein kinase、Raf-1などとも呼ばれる。c-RafはMAPK/ERK経路(ERK1/2経路)を構成し、Rasサブファミリーの下流のMAPキナーゼキナーゼキナーゼ(MAP3K)として機能する[7]。c-Rafはセリン/スレオニンキナーゼのRafキナーゼファミリーのメンバーであり、TKL(Tyrosine-kinase-like)グループに属する。
Remove ads
発見
最初のRafキナーゼであるv-Rafは1983年に発見された。3611-MSVと命名されたマウスレトロウイルスから単離され、齧歯類の線維芽細胞をがん細胞株へと形質転換することが示された。そのため、この遺伝子はvirus-induced rapidly accelerated fibrosarcoma(v-raf)と名付けられた。1年後、鳥類のレトロウイルスMH2から他の形質転換遺伝子が発見されてv-milと名付けられ、v-rafときわめて類似していることが判明した[8]。研究者らはこれらの遺伝子がセリン/スレオニンキナーゼ活性を持つ酵素をコードしていることを示した[9]。v-Rafとv-Milの正常な細胞性ホモログがマウスとニワトリの双方ですぐに発見され(細胞性(cellular)のRafを意味するc-Rafと名付けられた)、これらも成長や細胞分裂を調節する役割を持つことが明らかとなった[10][11]。現在ではc-Rafは、最初に記載されたMAPK経路であるERK1/2シグナル伝達経路の主要な構成要素であることが知られている[12]。c-RafはMAP3Kとして機能し、キナーゼカスケード全体の開始を担う。その後の実験によって、正常な細胞性のRafの遺伝子も変異によって、MEK1/2やERK1/2の活性を過剰に駆動するがん遺伝子となることが示された。脊椎動物のゲノムにはRafの遺伝子が複数含まれている。c-Rafの発見の数年後、2つの関連するキナーゼ、A-RafとB-Rafが記載された。ヒトの腫瘍の多くでB-Rafの遺伝子に発がん性をもたらす「ドライバー」変異が生じていることが判明し、近年B-Rafに研究の焦点が当てられている[13]。こうした変異は、制御を受けない高活性のRaf酵素を誘導する。Rafキナーゼに対する診断・治療標的としての関心は近年新たなピークに達している[14]。
Remove ads
構造
要約
視点
ヒトのc-Rafの遺伝子RAF1は3番染色体上に位置している。少なくとも2種類のアイソフォーム(選択的エクソンの組み込みまたは除去によるもの)が記載されているが、両者にはわずかな差異しか存在しない。主要な短いアイソフォームのmRNAは17個のエクソンから構成され、648アミノ酸からなるプロテインキナーゼをコードする[15]。

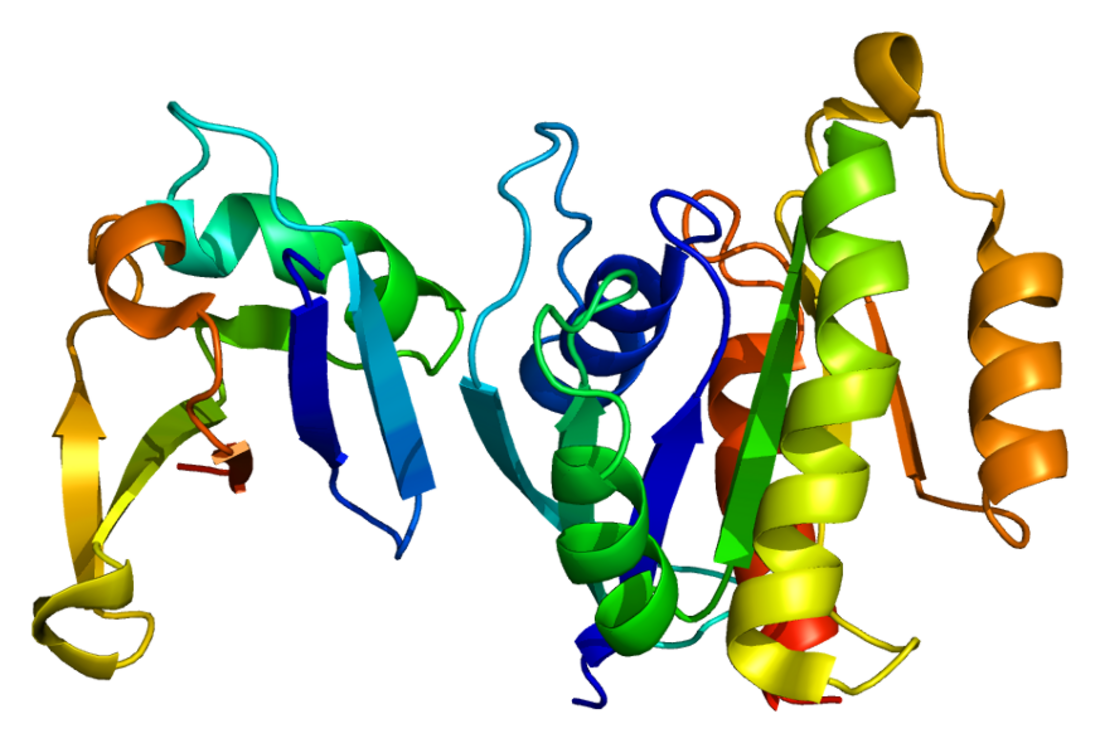
他の多くのMAP3Kと同様、c-Rafは複数のドメインから構成されるタンパク質で、触媒活性の調節を補助する複数の付加的なドメインが存在する。N末端領域には、Ras結合ドメイン(RBD)とCキナーゼ相同ドメイン1(C1ドメイン)が隣接して存在する。双方の保存されたドメイン構造がこれまでに解かれており、それらによる調節機構が解明されている。
RBDはユビキチン様フォールドを持ち(これは他の低分子量Gタンパク質結合ドメインの多くと同様である)、GTP結合型のRasタンパク質のみを選択的に結合する[16][17][18]。
C1ドメインはRBDの直後に存在し、システインに富み、2つの亜鉛イオンによって安定化される特別なジンクフィンガーである。プロテインキナーゼC(PKC)のジアシルグリセロール結合C1ドメインに類似しているが[19][20]、PKCとは異なり、RafファミリーキナーゼのC1ドメインはジアシルグリセロールを結合しない[21]。代わりに、セラミド[21]、ホスファチジン酸[22]などの他の脂質と相互作用し、活性化されたGTP結合型Rasの認識の補助も行う[20][23]。
これら2つのドメインがきわめて近接して存在していることや、いくつかの実験的データからは、これらは直接的な物理的相互作用を行うことでキナーゼドメインの活性を負に調節する単一のユニットとして機能することが示唆されている[24]。歴史的に、この自己阻害ブロックはCR1(Conserved Region 1)と呼ばれており、ヒンジ領域はCR2、キナーゼドメインはCR3と呼ばれていた。自己阻害状態のキナーゼの正確な構造はまだ明らかではない。
自己阻害ブロックとキナーゼドメインの間には、すべてのRafタンパク質に特有の長いフラグメントが存在する。このフラグメントはセリンに富むものの、関連するRafの間での配列の保存性は低い。この領域は構造を持たず、非常に柔軟性が高いようである。この領域の役割として最も可能性が高いのは、堅く折りたたまれた自己阻害ドメインと触媒ドメインとの間の「ヒンジ」としての機能であり、分子内の複雑な動きや大きなコンフォメーション変化を可能にしていると考えられている[25]。このヒンジ領域には、14-3-3タンパク質の認識を担う、小さな保存された領域(short linear motif)が含まれるが、認識が行われるのは重要なセリン残基(ヒトのc-Rafではセリン259番残基(Ser259))がリン酸化されているときのみである。同様のモチーフはすべてのRafのC末端付近(キナーゼドメインよりも下流、リン酸化されるSer621を中心とする領域)にも存在する。
c-RafのC末端側の半分は単一のドメインへと折りたたまれ、触媒活性を担う。このキナーゼドメインの構造は、c-Raf[26]とB-Raf[27]の双方で詳細に解明されている。このドメインは他のRafキナーゼやKSR(kinase suppressor of Ras)タンパク質ときわめて類似しており、MLK(mixed lineage kinase)ファミリーなど、他のMAP3Kの一部とも明らかに類似している。これらはプロテインキナーゼのTKL(tyrosine kinase like)グループを構成する。これらの触媒ドメインの特徴の一部はチロシンキナーゼとも共通であるが、TKLグループのキナーゼの活性は標的タンパク質のセリンとスレオニン残基のリン酸化に限定されている。Rafキナーゼの最も重要な基質は(自身を除くと)MEK1とMEK2キナーゼであり、これらキナーゼの活性はRafによるリン酸化に厳密に依存している。
Remove ads
進化的関係
要約
視点
→詳細は「Rafキナーゼ」を参照
ヒトのc-Rafが属するRafキナーゼファミリーには他にB-RafとA-Rafの2つのメンバーが存在し、これらは大部分の脊椎動物に存在する。保存されていないN末端とC末端領域の長さが異なる点を除いて、これらには共通したドメイン構成、構造、調節機構がみられる。c-RafとB-Rafに関しては比較的研究が進んでいるのに対し、A-Rafの正確な機能には不明点が多いが、類似した機能を持つと考えられている。これらをコードする遺伝子は、脊椎動物の進化の初期に起こった遺伝子またはゲノムの重複の結果、単一の祖先型Raf遺伝子から生じたと考えられている。他の動物の多くはRafを1つしか持ち合わせていない。ショウジョウバエDrosophilaではPhlまたはDrafと呼ばれており[28]、線虫Caenorhabditis elegansではLin-45と呼ばれている[29]。

また多細胞動物にはRafと密接に関連した、KSR(Kinase Suppressor of Ras)と呼ばれるキナーゼが存在する。哺乳類などの脊椎動物には、KSR1、KSR2という2つのパラログが存在する。C末端のキナーゼドメインはRafと非常に類似しているが(この領域はもともとKSRではCA5、RafではCR3と呼ばれていた)、N末端の調節領域は異なる。KSRにも柔軟なヒンジ領域(CA4)とC1ドメイン(CA3)が存在するが、Ras結合ドメインは全く存在しない。代わりにKSRには、CA1、CA2と名付けられた特有の調節領域がN末端に存在する。長らくCA1ドメインの構造は不明であったが、2012年にKSR1のCA1領域の構造が解かれ、コイルドコイルが付加されたSAM(Sterile alpha motif)ドメイン(CC-SAM)構造であることが明らかにされた。この領域はKSRの膜結合を補助していると考えられている[30]。Rafと同様、KSRにもリン酸化依存的な14-3-3結合モチーフが2つ存在するが、KSRのヒンジ領域にはさらにMAPK結合モチーフが存在する。このモチーフの典型的な配列はPhe-x-Phe-Pro(FxFP)であり、ERK1/2経路におけるRafキナーゼのフィードバック調節に重要である。これまで知られているところによると、KSRはRafと同じ経路に関与するが、副次的な役割しか持たない。KSRの内在的なキナーゼ活性は極めて弱いため、近年になってようやく活性が実証されるまで長らく不活性な因子であると考えられていた[31][32]。しかしKSRのキナーゼ活性はMEK1やMEK2のリン酸化には無視できるほどの寄与しかしていない。KSRの主要な役割はRafのヘテロ二量体化のパートナーとなることであるようで、アロステリック機構によってRafの活性化を大きく促進する。同様の現象は他のMAP3Kに関しても記載されている。例えば、ASK2はそれ自身では活性の弱い酵素であるが、ASK1とのヘテロ二量体として活性を持つ[33]。
活性の調節
要約
視点

c-Rafの活性の調節は複雑である。c-RafはERK1/2経路の「ゲートキーパー」としての役割を持ち、その活性化は多数の阻害機構によって阻止され、通常は一段階で活性化されることはない。最も重要な調節機構は、N末端の自己阻害ブロックとキナーゼドメインとの直接的な物理的相互作用である。その結果、触媒部位が閉じられ、キナーゼ活性は完全に停止する[24]。この「閉じた」状態は、Rafの自己阻害ドメインがキナーゼドメインと競合するパートナー(最も重要なものはGTP結合型のRas)と結合したときにのみ解除される。活性化された低分子量Gタンパク質はc-Rafの分子内相互作用を解除し、その結果としてc-Rafにはコンフォメーション変化が起こり、キナーゼの活性化と基質の結合に必要な「開いた」状態となる[36]。
14-3-3タンパク質も自己阻害に寄与する。14-3-3は常に二量体を形成していることが知られており、二量体には2つの結合部位が存在する[37]。二量体は「手錠」のように機能し、結合パートナーを一定の距離と配向に固定する。c-Rafの2つの14-3-3結合モチーフが正確に配置され、そこへ1つの14-3-3タンパク質二量体(14-3-3ζなど)が結合した場合、c-Rafは自己阻害を促進し、自己阻害ドメインと触媒ドメインの解離を許容しないコンフォメーションへと固定される[38]。このc-Rafの固定(他のRafやKSRでも起こる)は、14-3-3結合モチーフのリン酸化によって制御されている。リン酸化されていない14-3-3結合モチーフにはパートナーは結合せず、他のプロテインキナーゼによって保存されたセリン(Ser259とSer621)がリン酸化されている必要がある。このイベントへの関与が示唆されている最も重要なキナーゼはTAK1(TGF-β activated kinase 1)であり、リン酸基の除去を行う酵素はプロテインホスファターゼ1とプロテインホスファターゼ2A複合体である[39][40]。
Rafへの14-3-3の結合は必ずしも阻害的に働くわけではないことには注意が必要である。いったんRafが開いた構造となって二量体化すると、14-3-3は2つのキナーゼの間を橋渡しするようにトランスに結合し、二量体を離すためではなく、結合を強化するための「手錠」として機能する[41]。c-Rafと14-3-3の結合にはさらに他の様式も存在するが、それらの役割はあまり解明されていない[42]。
二量体化もc-Rafの活性の調節に重要な機構であり、Rafの活性化ループのリン酸化に必要である。通常は、「開いた」構造のキナーゼドメインのみが二量体化を行う。c-Rafのホモ二量体も他の因子とのヘテロ二量体も同様な振る舞いを示す[32]。

c-Rafが十分な活性を持ち、活性化状態が安定化されるためには、さらにc-Rafの活性化ループのリン酸化が必要である。現在のところ、この役割を果たすことが知られている唯一のキナーゼはRafファミリーキナーゼ自身である。しかし、PAK1など他の一部のキナーゼもc-Rafのキナーゼドメイン近傍の他の残基をリン酸化することができる。これらの副次的なキナーゼの正確な役割は未知である。c-Rafの場合、活性化ループの「トランスリン酸化」にはc-RafとKSR1の双方が必要である。二量体は背中合わせに結合した構造をしているため、このリン酸化はトランスにのみ起こる(ある二量体が他の二量体のリン酸化行い、4つのメンバーからなる一過的複合体が形成される)[43]。キナーゼドメインの保存されたアルギニン残基とリジン残基との相互作用によって、リン酸化された活性化ループはコンフォメーションのシフトが起こってしっかりとした構造をとるようになり、脱リン酸化が起こるまでキナーゼドメインを完全に活性化された状態に固定する。また、リン酸化された活性化ループによってキナーゼは自己阻害ドメインの存在に対して非感受性となる[44]。KSRの活性化ループにはリン酸化残基が存在しないため、この最終段階は起こらない。いったんc-Rafが完全に活性化されるとそれ以上の活性化は必要なく、活性化されたRafは自身の基質と結合できるようになる[45]。大部分のプロテインキナーゼと同様に、c-Rafは複数の基質を持っている。BAD[46]、アデニル酸シクラーゼのいくつか[47]、ミオシン軽鎖ホスファターゼ(MYPT)[48]、心筋トロポニンT(TnTc)[49]などがc-Rafによって直接リン酸化される。Rbタンパク質やCdc25ホスファターゼも基質である可能性が示唆されている[50]。
全てのRaf型酵素の最も重要な標的は、MEK1とMEK2である。c-RafとMEK1の酵素-基質複合体の構造は未解明であるが、KSR2-MEK1複合体の構造から正確なモデリングを行うことが可能である[32]。この複合体では実際には触媒は行われないが、Rafの基質への結合様式はきわめて類似していると考えられている。主要な相互作用面は両者のキナーゼドメインのC末端ローブによってもたらされ、MEK1とMEK2に特有の大きく、ディスオーダーしたプロリンに富むループもRaf(とKSR)の配置に重要な役割を果たす[51]。MEKはRafへの結合に伴って活性化ループの少なくとも2か所がリン酸化され、これによってMEKは活性化される。このキナーゼカスケードの標的はERK1とERK2であり、MEK1またはMEK2によって選択的に活性化される。ERKは細胞内に無数の基質を持ち、転写因子を活性化するために核内へ移行させることもできる。活性化されたERKは細胞生理の多能的なエフェクターであり、細胞分裂サイクル、細胞移動、アポトーシスの阻害、細胞分化に関与する遺伝子の発現制御に重要な役割を果たす。
Remove ads
関係するヒトの疾患
c-Rafの遺伝的な機能獲得型変異は、稀であるが重篤な症候群のいくつかに関与している。こうした変異の大部分は、2つの14-3-3結合モチーフのうちの1つに1か所のアミノ酸置換が生じているものである[52][53]。c-Rafの変異はヌーナン症候群の原因の1つであると考えられている。ヌーナン症候群の患者は先天性心疾患、低身長や他の奇形がみられる。c-Rafの同様の変異は、関連疾患であるLEOPARD症候群と呼ばれる複雑な欠陥がみられる疾患の原因ともなる。
がんにおける役割
c-Rafは実験的条件下では明らかにがん遺伝子へ変異する能力を持ち、ヒトの少数の腫瘍でもがん遺伝子への変異がみられるが[54][55]、ヒトの発がんにおいて実際に主要な役割を果たしているのは姉妹キナーゼのB-Rafである[56]。
B-Rafの変異
調査されたすべてのヒト腫瘍試料の約20%でB-Rafの遺伝子に変異がみられる[57]。これらの変異の圧倒的多数はV600Eの1アミノ酸置換を伴うもので、この異常な遺伝子産物(BRAF-V600E)は臨床分子診断において免疫組織染色によって可視化することができる[58][59]。この置換は活性化ループのリン酸化を模倣するものであり、正常な活性化制御段階の全てを飛び越えて、即座にキナーゼドメインを完全に活性化された状態にする[60]。B-Rafはホモ二量体化によって自身を、そしてヘテロ二量体化によってc-Rafを活性化することができるため、この変異はERK1/2経路を恒常的に活性化して無制御な細胞分裂を駆動し、壊滅的な影響を与える[61]。
Remove ads
治療標的として
RasとB-Rafの変異はどちらも腫瘍形成に重要であるため、特にV600E変異を有するB-Rafを標的としたいくつかのRaf阻害剤ががんに対する治療薬として開発されている。ソラフェニブは臨床的に有用な最初の薬剤であり、腎細胞がんや悪性黒色腫など、それまでほとんど治療不能であった悪性腫瘍に対して薬理学的な代替手段をもたらした[62]。ベムラフェニブ、レゴラフェニブ、ダブラフェニブなど、いくつかの分子が続いて開発されている。
ATP競合型のB-Raf阻害剤は、K-Ras依存的ながんに望ましくない影響を与える可能性がある。これらはB-Rafの変異が主要因である場合にはB-Rafの活性を完全に阻害するが、それとともにB-Raf自身のホモ二量体化やc-Rafとのヘテロ二量体化も促進する。そのためRafの遺伝子には変異が存在せず、Rafの共通の上流活性化因子であるK-Rasに変異が生じている場合には、c-Rafを阻害するのではなく活性を高めることとなる[26]。この「逆説的」なc-Rafの活性化が起こる可能性があるため、B-Raf阻害剤による治療を始める前には遺伝子診断によって患者のB-Rafの変異のスクリーニングを行う必要がある[63]。
Remove ads
相互作用
RAF1は次に挙げる因子と相互作用することが示されている。
- AKT1[64]
- ASK1[65]
- BAG1[66]
- BRAF[67]
- Bcl-2[68]
- CDC25A[69][70]
- CFLAR[71]
- FYN[72]
- GRB10[73][74]
- HRAS[75][76][77][78][79][80][81][82][83][84][85][86][87][88][89][90][91]
- HSP90AA1[92][93]
- KRAS[80][81]
- MAP2K1[94]
- MAP3K1[95]
- MAPK7[96]
- MAPK8IP3[97][98]
- PAK1[99]
- PEBP1[94]
- PHB[100]
- PRKCZ[101]
- RAP1A[16][85][102][103]
- RHEB[104][105][106]
- RRAS2[80][107]
- RB1[100][108]
- RBL2[108]
- SHOC2[80]
- STUB1[92]
- SRC[72]
- TSC22D3[109]
- YWHAB[79][101][110][111][112][113]
- YWHAE[112][113]
- YWHAG[101][114][115]
- YWHAH[101][112][116]
- YWHAQ[94][101][114][117]
- YWHAZ[101][118][119][120][121]
Remove ads
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads