상위 질문
타임라인
채팅
관점
주기 (주기율표)
주기율표에서 표의 가로줄 위키백과, 무료 백과사전
Remove ads
주기율표에서 주기(周期, Period)는 화학 원소의 행(가로줄)이다. 한 행의 모든 원소는 동일한 수의 전자 껍질을 가진다. 한 주기의 다음 각 원소는 양성자를 하나 더 가지고 이전 원소보다 금속성이 적다. 이러한 방식으로 배열된 동일한 족(열)에 있는 원소는 주기율을 반영하여 유사한 화학적 및 물리적 성질을 가진다. 예를 들어, 할로젠은 끝에서 두 번째 족(17족)에 속하며, 높은 반응성과 하나의 전자를 얻어 비활성 기체 전자 배열에 도달하려는 경향과 같은 유사한 특성을 공유한다. 2025년 기준 총 118개의 원소가 발견 및 확인되었다.
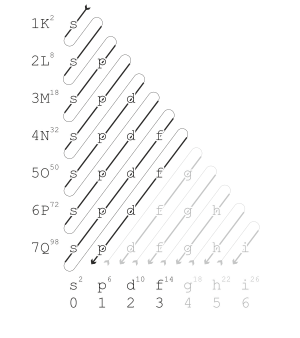

현대 양자역학은 이러한 속성의 주기적 경향을 가지는 이유를 전자 껍질로 설명한다. 원자 번호가 증가할수록 껍질은 순서 규칙 다이어그램에 표시된 대략적인 순서로 전자로 채워진다. 각 껍질이 채워지는 것은 표의 한 행에 해당한다.
주기율표의 F-구역과 P-구역에서 같은 주기 내의 원소는 일반적으로 속성에서 경향이나 유사성을 보이지 않는다(족을 따라가는 수직적 경향이 더 중요하다). 그러나 D-구역에서는 주기를 가로지르는 경향이 중요해지고, F-구역 원소에서는 주기를 가로지르는 높은 유사성이 나타난다.
Remove ads
주기
요약
관점
현재 주기율표에는 118개의 알려진 원소를 포함하여 7개의 완전히 차 있는 주기가 있다. 새로운 원소는 8주기에 배치될 것이다. 확장 주기율표를 참조하라. 원소들은 아래에서 구역별로 색상이 지정되어 있다. S-구역은 빨간색, P-구역은 노란색, D-구역은 파란색, F-구역은 녹색이다.
1주기
1주기는 다른 주기보다 적은 수의 원소를 포함하며, 오직 두 가지, 수소와 헬륨만 있다. 따라서 이들은 옥텟 규칙을 따르지 않고 이중체 규칙을 따른다. 화학적으로 헬륨은 비활성 기체처럼 행동하므로 18족 원소의 일부로 간주된다. 그러나 핵 구조 측면에서는 S-구역에 속하므로 때로는 2족 원소로 분류되거나, 동시에 2족과 18족으로 분류되기도 한다. 수소는 전자를 쉽게 잃거나 얻으므로 화학적으로 1족 원소와 17족 원소 모두처럼 행동한다.
- 수소 (H)는 가장 풍부한 화학 원소이며, 우주 전체 원소 질량의 약 75%를 차지한다.[1] 이온화된 수소는 그저 양성자이다. 주계열 항성들은 주로 플라스마 상태의 수소로 구성되어 있다. 원소 상태의 수소는 지구상에서 비교적 희귀하며, 메테인과 같은 탄화수소에서 산업적으로 생산된다. 수소는 대부분의 원소와 화합물을 형성할 수 있으며, 물과 대부분의 유기 화합물에 존재한다.[2]
- 헬륨 (He)은 극단적인 조건을 제외하고는 오직 기체로만 존재한다.[3] 헬륨은 두 번째로 가벼운 원소이며 우주에서 두 번째로 풍부하다.[4] 대부분의 헬륨은 대폭발 동안 형성되었지만, 새로운 헬륨은 별에서 수소의 핵융합을 통해 생성된다.[5] 지구상에서 헬륨은 비교적 희귀하며, 일부 방사성 원소의 자연적인 붕괴의 부산물로만 발생한다.[6] 이러한 '방사성 발생' 헬륨은 천연가스에 부피 기준으로 최대 7%의 농도로 갇혀 있다.[7]
2주기
2주기 원소에는 2s 및 2p 원자 궤도가 포함된다. 이들은 수소 외에 생물학적으로 가장 필수적인 원소인 탄소, 질소, 산소가 있다.
- 리튬 (Li)은 가장 가벼운 금속이며 가장 밀도가 낮은 고체 원소이다.[8] 비이온화 상태에서는 가장 반응성이 높은 원소 중 하나이므로 자연에서는 항상 화합물 형태로만 발견된다. 이것은 대폭발 동안 대량으로 형성된 가장 무거운 원시 원소이다.
- 베릴륨 (Be)은 모든 경금속 중에서 가장 높은 녹는점 중 하나를 가지고 있다. 소량의 베릴륨은 대폭발 동안 합성되었지만, 대부분은 핵 붕괴하거나 별 내부에서 탄소, 질소, 산소와 같은 더 큰 핵을 만들기 위해 추가로 반응했다. 베릴륨은 국제 암 연구 기관에서 1군 발암 물질로 분류된다.[9] 1%에서 15%의 사람들이 베릴륨에 민감하며, 호흡계와 피부에 만성 베릴륨 질환이라고 불리는 염증 반응을 일으킬 수 있다.[10] 제임스 웹 우주 망원경(JWST)의 주 거울은 베릴륨으로 만들어졌다.
- 붕소 (B)는 자유 원소로 자연적으로 발생하지 않지만, 붕산염과 같은 화합물 형태로 존재한다. 붕소는 세포벽 강도와 발달, 세포 분열, 씨앗 및 과일 발달, 설탕 운반 및 호르몬 발달에 필요한 필수 식물 미량영양소이다.[11][12] 그러나 높은 수준은 독성이 있다.
- 탄소 (C)는 수소, 헬륨, 산소에 이어 우주에서 질량 기준으로 네 번째로 풍부한 원소이며[13], 산소에 이어 질량 기준으로 인체에서 두 번째로 풍부한 원소이며[14], 원자 수로는 세 번째로 풍부하다.[15] 탄소가 C-C 결합의 길고 안정적인 사슬을 형성할 수 있는 능력 때문에 탄소를 포함하는 화합물의 수는 거의 무한하다.[16][17] 생명에 필수적인 모든 유기 화합물은 적어도 하나의 탄소 원자를 포함한다.[16][17] 수소, 산소, 질소, 황, 인과 결합하여 탄소는 모든 중요한 생물학적 화합물의 기초를 이룬다.[17]
- 질소 (N)는 주로 대부분 비반응성인 이원자 분자 가스 N2로 발견되며, 이는 지구 대기 부피의 78%를 차지한다. 질소는 단백질의 필수 성분이며 따라서 생명에 필수적이다.
- 산소 (O)는 대기 부피의 21%를 차지하며, 모든 (또는 거의 모든) 동물에게 호흡에 필요하며, 물의 주요 구성 요소이다. 산소는 우주에서 세 번째로 풍부한 원소이며, 산소 화합물은 지구 지각을 지배한다.
- 플루오린 (F)은 비이온화 상태에서 가장 반응성이 높은 원소이므로 자연에서는 그렇게 발견되지 않는다.
- 네온 (Ne)은 네온 조명에 사용되는 비활성 기체이다.
3주기
모든 3주기 원소는 자연에서 발생하며 적어도 하나의 안정 동위 원소를 가진다. 아르곤을 제외한 모든 비활성 기체는 기본적인 지질학 및 생물학에 필수적이다.
- 나트륨 (Na)은 알칼리 금속이다. 염화 나트륨(식용 소금) 형태로 지구의 바다에 대량으로 존재한다.
- 마그네슘 (Mg)은 알칼리 토금속이다. 마그네슘 이온은 엽록소에서 발견된다.
- 알루미늄 (Al)은 전이후 금속이다. 지구 지각에서 가장 풍부한 금속이다.
- 규소 (Si)는 준금속이다. 반도체이므로 많은 집적 회로의 주요 구성 요소이다. 이산화 규소는 모래의 주요 구성 성분이다. 탄소가 생물학에 미치는 영향과 같이 규소는 지질학에 중요하다.
- 인 (P)은 비금속이며 DNA에 필수적이다. 반응성이 매우 높으므로 자연에서는 자유 원소로 발견되지 않는다.
- 황 (S)은 비금속이다. 두 가지 아미노산인 시스테인과 메티오닌에서 발견된다.
- 염소 (Cl)는 할로젠이다. 가장 반응성이 높은 원소 중 하나이므로 지구 표면에서 주로 염화 나트륨으로 발견된다. 그 화합물은 소독제로, 특히 수영장에서 사용된다.
- 아르곤 (Ar)은 비활성 기체이므로 거의 완전히 비반응성이다. 백열등은 높은 온도에서 필라멘트를 보존하기 위해 종종 아르곤과 같은 비활성 기체로 채워진다.
4주기

4주기는 생물학적으로 필수적인 원소인 칼륨과 칼슘을 포함하며, 더 가벼운 전이 금속을 가진 D-구역의 첫 번째 주기이다. 여기에는 주계열 항성에서 생성된 가장 무거운 원소이자 지구의 주요 구성 요소인 철을 비롯하여 코발트, 니켈, 구리와 같은 다른 중요한 금속들이 포함된다. 거의 모든 원소가 생물학적 역할을 한다.
5주기
5주기는 4주기와 동일한 수의 원소를 가지며, 동일한 일반적인 구조를 따르지만 전이후 금속이 하나 더 많고 비금속이 하나 더 적다. 생물학적 역할을 하는 세 가지 가장 무거운 원소 중 두 가지(몰리브데넘과 아이오딘)가 이 주기에 속한다. 6주기의 텅스텐은 더 무겁고, 초기 란타넘족 원소 중 몇 가지도 마찬가지이다. 5주기는 또한 가장 가벼운 전적으로 방사성 원소인 테크네튬을 포함한다.
6주기
6주기는 란타넘족(일명 희토류 원소)을 포함하는 F-구역을 포함하는 첫 번째 주기이며, 가장 무거운 안정 원소를 포함한다. 이 중금속 중 다수는 독성이 있고 일부는 방사성이지만, 백금과 금은 대체로 비활성이다.
7주기
7주기의 모든 원소는 방사성이다. 이 주기에는 지구에서 자연적으로 발생하는 가장 무거운 원소인 플루토늄이 포함된다. 이 주기 이후의 모든 원소는 인공적으로 합성되었다. 이 중 다섯 개(아메리슘부터 아인슈타이늄까지)는 현재 거시적 양으로 얻을 수 있지만, 대부분은 극히 희귀하며, 마이크로그램 이하의 양으로만 제조되었다. 일부 후기 원소는 실험실에서 한 번에 몇 개의 원자량으로만 식별되었다.
이러한 원소들 중 다수의 희귀성 때문에 실험 결과가 그리 광범위하지는 않지만, 7주기의 행동에서 주기적 및 족적 경향은 다른 주기보다 덜 명확하게 정의되는 것으로 보인다. 프랑슘과 라듐은 각각 1족과 2족의 전형적인 특성을 보이지만, 악티늄족은 란타넘족보다 훨씬 더 다양한 행동과 산화수를 나타낸다. 7주기의 이러한 특이성은 다양한 요인, 특히 높은 정도의 스핀-궤도 결합과 상대론적 효과 때문일 수 있으며, 이는 궁극적으로 그들의 거대한 원자핵으로부터 오는 매우 높은 양의 전하 때문에 발생한다.
8주기
아직 8주기 원소는 합성되지 않았다. G-구역에 전자가 들어갈 것으로 예측된다. 8주기에 예측된 모든 원소가 실제로 물리적으로 가능한지는 명확하지 않다. 따라서 9주기가 없을 수도 있다.
Remove ads
같이 보기
각주
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
