상위 질문
타임라인
채팅
관점
탄산
화합물 위키백과, 무료 백과사전
Remove ads
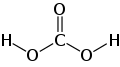
탄산(炭酸, carbonic acid)은 이산화 탄소의 수용액으로, 약한 산성을 띈다. 분자식은 H2CO3이다.
이 문서의 내용은 출처가 분명하지 않습니다. (2019년 11월) |
Remove ads
제조
- CO2 + H2O ⇌ H2CO3
화학적 성질
탄산은 불안정하여 물과 이산화 탄소로 분해되려는 경향이 비교적 강하다. 이는 탄산음료를 흔들었을 때 나타나는 반응을 통해 설명할 수 있다.
탄산음료를 처음 개봉하면 김 빠지는 소리와 함께 음료에서 기포가 올라오는데, 이는 높은 압력에서 용해되어있던 탄산이 개봉으로 인해 압력이 낮아지면서 이산화 탄소와 물로 분해되며 나타나는 반응이다. 멘토스와 같은 표면장력을 약하게 만들 수 있는 물체와 접촉하면 표면 촉매가 일어나는데, 그 이유는 멘토스 표면의 미세한 구멍이 탄산을 이산화 탄소와 물로 분해하는 반응을 촉진시키기 때문이다. 또한 이러한 반응은 꼭 멘토스뿐만 아니라 아이스크림과 같이 표면이 거칠고 미세한 구멍이 많이 난 물체라면 얼마든지 가능하다.
금속과의 반응
탄산은 산성도가 비교적 약하기 때문에 반응성이 적다. 때문에 주로 알칼리 금속이나 알칼리 토금속 등의 반응성이 큰 금속에서 잘 반응한다.
나트륨과의 반응
탄산과 수산화나트륨이 1:1로 반응하면 탄산수소 나트륨이, 1:2로 반응하면 탄산 나트륨이 만들어진다.
- H2CO3 + NaOH → NaHCO3 + H2O
- H2CO3 + 2 NaOH → Na2CO3 + 2 H2O
칼슘과의 반응
석회수(수산화 칼슘 용액)에 이산화 탄소를 용해시키면 탄산이 형성되어 뿌옇게 변하면서 불용성의 탄산 칼슘(석회암과 분필의 주성분)이 만들어진다.
- H2CO3 + Ca(OH)2 → CaCO3 + 2 H2O
기타 특성
Remove ads
용도
같이 보기
각주
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads