상위 질문
타임라인
채팅
관점
프리델-크래프츠 반응
위키백과, 무료 백과사전
Remove ads
프리델-크래프츠 반응(영어: Friedel–Crafts reaction)은 샤를 프리델과 제임스 크래프츠가 1877년에 방향족 고리에 치환기를 붙이기 위해 개발한 유기 반응들의 집합이다.[1] 프리델-크래프츠 반응에는 크게 두 가지 유형이 있다: 알킬화 반응과 아실화 반응. 둘 다 친전자성 방향족 치환을 통해 진행된다.[2][3][4][5]

Remove ads
알킬화
요약
관점
알켄을 이용한 알킬화
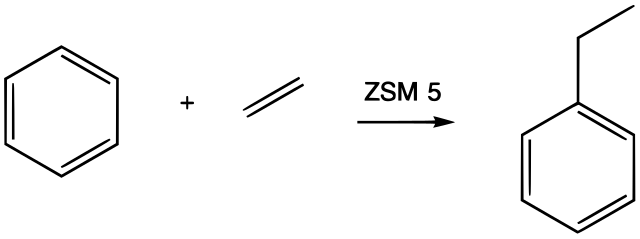
상업적 응용에서 알킬화제는 일반적으로 알켄이며, 산업에서 가장 큰 규모로 실행되는 반응 중 일부이다. 이러한 알킬화는 산업적으로 매우 중요하며, 예를 들어 벤젠과 에틸렌으로부터 폴리스티렌의 전구체인 에틸벤젠을 생산하고 큐멘 공정에서 벤젠과 프로펜으로부터 큐멘을 생산하는 데 사용된다:
알킬 할라이드를 이용한 알킬화
프리델-크래프츠 알킬화는 방향족 고리의 알킬화를 포함한다. 전통적으로 알킬화제는 할로알케인이다. 알킬 할라이드 대신 많은 알킬화제를 사용할 수 있다. 예를 들어, 엔온과 에폭사이드는 양성자의 존재하에 사용될 수 있다. 이 반응은 일반적으로 알킬화제의 친전자성을 높이기 위해 염화 알루미늄과 같은 강한 루이스 산을 촉매로 사용한다.[6]
이 반응은 알킬기가 프리델-크래프츠 반응의 활성제이기 때문에 생성물이 반응물보다 더 친핵성이라는 단점이 있다. 결과적으로 과도한 알킬화가 발생할 수 있다. 그러나 입체 장애를 이용하여 연속적인 알킬화 주기의 수를 제한할 수 있는데, 예를 들어 1,4-다이메톡시벤젠의 t-뷰틸화에서는 두 번의 알킬화 주기 생성물만 얻어지고 세 가지 가능한 이성질체 중 하나만 생성된다:[7]
또한, 이 반응은 5- 또는 6-원 고리가 형성될 때 분자내적으로만 일차 알킬 할라이드에 유용하다. 분자간의 경우, 이 반응은 삼차 알킬화제, 일부 이차 알킬화제(탄소 양이온 자리옮김이 축퇴된 것), 또는 안정화된 탄소 양이온을 생성하는 알킬화제(예: 벤질 또는 알릴)로 제한된다. 일차 알킬 할라이드의 경우, 탄소 양이온과 유사한 복합체(R(+)---X---Al(-)Cl3)는 탄소 양이온 자리옮김 반응을 겪어 거의 전적으로 이차 또는 삼차 탄소 양이온에서 파생된 재배열 생성물을 생성한다.[8]
알켄의 양성자화는 친전자체인 탄소 양이온을 생성한다. 벤젠과 메트알릴 염화물로부터 네오필 염화물을 황산 촉매를 사용하여 합성하는 것이 실험실 규모의 예이다.[9]
메커니즘
일차 알킬 할라이드의 일반적인 메커니즘은 아래 그림에 나와 있다.[8]
프리델-크래프츠 탈알킬화
프리델-크래프츠 알킬화는 가역적일 수 있다. 이것은 일반적으로 바람직하지 않지만 활용될 수 있다. 예를 들어 알킬교환 반응을 촉진함으로써 그러하다.[10]

또한 알킬 사슬을 보호기로 가역적으로 첨가할 수 있다. 이 접근법은 2,6-다이-tert-뷰틸페놀의 산화적 짝지음과 이은 탈알킬화를 통한 4,4'-바이페놀 합성에 산업적으로 사용된다.[11][12]
Remove ads
아실화
요약
관점
프리델-크래프츠 아실화는 방향족 고리의 아실화를 포함한다. 전형적인 아실화제는 염화 아실이다. 산 무수물과 카복실산도 가능하다. 전형적인 루이스 산 촉매는 염화 알루미늄이다. 그러나 생성물인 케톤은 AlCl3와 같은 루이스 산과 상당히 안정한 착물을 형성하기 때문에, 촉매가 지속적으로 재생되는 프리델-크래프츠 알킬화의 경우와 달리 일반적으로 화학량론적 양 이상의 "촉매"를 사용해야 한다.[13] 반응 조건은 프리델-크래프츠 알킬화와 유사하다. 이 반응은 알킬화 반응에 비해 여러 가지 장점이 있다. 카보닐기의 전자를 끄는 효과 때문에 케톤 생성물은 항상 원래 분자보다 덜 반응적이므로 여러 번의 아실화가 발생하지 않는다. 또한 아실륨 이온은 산소에 양전하가 있는 공명 구조에 의해 안정화되므로 탄소 양이온 재배열이 없다.
프리델-크래프츠 아실화의 가능성은 염화 아실 시약의 안정성에 달려 있다. 예를 들어, 포르밀 염화물은 너무 불안정하여 분리할 수 없다. 따라서 프리델-크래프츠 경로를 통한 벤즈알데하이드 합성은 포르밀 염화물이 현장에서 합성되어야 한다. 이것은 가터만-코흐 반응에 의해 달성되며, 벤젠을 일산화 탄소와 염화 수소와 함께 고압에서 염화 알루미늄과 염화 제일구리의 혼합물에 의해 촉매화하여 처리함으로써 이루어진다. 프리델-크래프츠 아실화로 얻을 수 있는 단순 케톤은 산업에서 산화와 같은 다른 방법으로 생산된다.
반응 메커니즘
이 반응은 아실륨 중심의 생성을 통해 진행된다. 반응은 AlCl4−에 의한 아레늄 이온의 탈양성자화로 완료되어 AlCl3 촉매를 재생한다. 그러나 진정한 촉매적 알킬화 반응과 달리, 생성된 케톤은 온화한 루이스 염기이며, 강한 루이스 산인 염화 알루미늄과 착물을 형성한다. 이 착물의 형성은 일반적으로 반응 조건에서 비가역적이다. 따라서 화학량론적 양의 AlCl3가 필요하다. 착물은 수성 반응 후 처리 시 파괴되어 원하는 케톤을 제공한다. 예를 들어, 데옥시벤조인의 고전적인 합성은 제한 시약인 페닐아세틸 염화물에 대해 1.1당량의 AlCl3를 필요로 한다.[14] 특정 경우, 일반적으로 벤젠 고리가 활성화될 때, 프리델-크래프츠 아실화는 더 약한 루이스 산(예: Zn(II) 염) 또는 브뢴스테드 산 촉매의 촉매량으로 무수물 또는 심지어 카복실산 자체를 아실화제로 사용하여 수행될 수도 있다.
원하는 경우, 생성된 케톤은 나중에 볼프-키슈너 환원 또는 클레멘젠 환원에 의해 해당 알칸 치환체로 환원될 수 있다. 순 결과는 재배열이 불가능하다는 점을 제외하고 프리델-크래프츠 알킬화와 동일하다.[15]
Remove ads
하이드록시알킬화
아렌은 특정 알데하이드 및 케톤과 반응하여 하이드록시알킬화된 생성물을 형성한다. 예를 들어 글리옥살의 메시틸 유도체와 벤젠의 반응에서:[16]
평소와 같이 알데하이드 그룹은 페논보다 더 반응성이 높은 친전자체이다.
범위 및 변형
요약
관점
이 반응은 여러 고전적인 명명 반응과 관련이 있다:
- 아실화된 반응 생성물은 클레멘젠 환원 또는 볼프-키슈너 환원을 통해 알킬화된 생성물로 전환될 수 있다.[17]
- 가터만-코흐 반응은 벤젠으로부터 벤즈알데하이드를 합성하는 데 사용될 수 있다.[18]
- 가터만 반응은 시안화수소산과의 아렌 반응을 설명한다.[19][20]
- 하우벤-회쉬 반응은 나이트릴과의 아렌 반응을 설명한다.[21]
- 반응 변형에서 방향족 페닐 에스터를 반응물로 사용하는 것을 프라이스 재배열이라고 한다.
- 숄 반응에서는 두 아렌이 직접 짝지음된다(때로는 프리델-크래프츠 아릴화라고도 불린다).[22]
- 블랑 클로로메틸화에서는 포름알데하이드, 염산, 염화 아연을 사용하여 아렌에 클로로메틸 그룹이 추가된다.
- 보거트-쿡 합성(1933)은 1-베타-페닐에틸사이클로헥산올의 탈수 반응과 이성질체화 반응을 통해 페난트렌의 옥타하이드로 유도체를 생성한다.[23]
- 다르젠스-네니체스쿠 케톤 합성(1910, 1936)은 아세틸 염화물로 시클로헥센을 아실화하여 메틸사이클로헥세닐케톤을 생성하는 반응이다.
- 관련 네니체스쿠 환원 아실화(1936)에서는 포화된 탄화수소를 첨가하여 메틸사이클로헥실케톤으로 환원 아실화한다.
- 넨츠키 반응(1881)은 염화 아연 존재 하에 산과 함께 페놀 고리의 아세틸화이다.[24]
- 녹색 화학 변형에서 염화 알루미늄은 2-브로모뷰테인을 이용한 P-자일렌의 알킬화에서 흑연으로 대체된다. 이 변형은 일차 할라이드에서는 작동하지 않으며, 이는 탄소 양이온의 개입이 적음을 시사한다.[25]
염료
프리델-크래프츠 반응은 여러 트라이페닐메테인 및 잔텐 염료 합성에서 사용되었다.[26] 예를 들어, 티몰 (화합물) 두 당량과 무수 프탈산으로부터 티몰프탈레인 (pH 지시약)을 합성하는 것이다.
염화 아연 존재 하에 무수 프탈산과 레조르시놀의 반응은 형광체인 플루오레세인을 생성한다. 이 반응에서 레조르시놀을 N,N-다이에틸아미노페놀로 대체하면 로다민 B가 생성된다:
하워스 합성
하워스 합성은 다환 방향족 탄화수소를 합성하는 고전적인 방법이다. 이 반응에서 아렌은 숙신산 무수물과 반응하고, 이후의 생성물은 클레멘젠 환원 또는 볼프-키슈너 환원 중 하나로 환원된다. 마지막으로, 산을 첨가하여 두 번째 프리델-크래프츠 아실화가 일어난다.[27]
이 반응에서 형성된 생성물은 유사하게 환원된 후, SeO2와 같은 시약을 사용하여 탈수소화 반응을 거쳐 방향족 고리 시스템을 확장한다.[28]
방향족 탄화수소에 대한 프리델-크래프츠 시험
염화 알루미늄 촉매를 사용하여 클로로포름과 방향족 화합물이 반응하면 트라이아릴메테인이 생성되는데, 이는 종종 트라이아릴메테인 염료의 경우처럼 밝은 색을 띤다. 이것은 방향족 화합물에 대한 벤치 테스트이다.[29]
Remove ads
같이 보기
- 프리델 가문: 프랑스 과학자 가문
- 하이드로탈알킬화
- 알킬교환 반응
각주
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads











