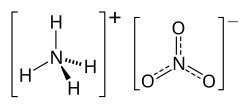
Амониум нитрат
хемиско соединение From Wikipedia, the free encyclopedia
Remove ads
Амониум нитрат се употребува за правење на експлозиви полнење на гранати и др. Исто така тој се употребува за огномети и за исфрлање на огнометите. Формулата за амониум нитрат е NH4NO3, тој не се продава на пазарот бидејќи со него се прават експлозиви.
Remove ads
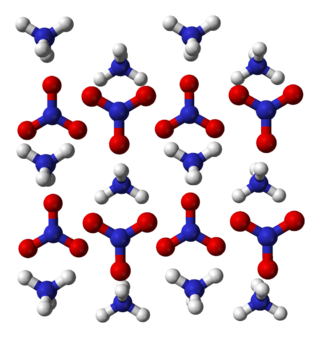
Кристални фази
Кристалното уредување на амониум нитрат се менува во зависност од притисокотт и од температурата. Одредени се селдниве кристални фази:
Remove ads
Појава
Амониум нитратот се наоѓа како природен минерал (амонијак нитре - амониум аналоген на калиум нитрат (хемиска формула KNO3), или шалитра и други нитре минерали како натриум нитрат во сушните региони на пустината Атакама во Чиле, често како кора на почвата и во комбинација со други нитрати, хлорат, јодат и халидни минерали. Амониум нитрат во минатото се ископувал, но денес речиси 100% е синтетички.
Remove ads
Добивање
Индустриското производство на амониум нитрат се добива од киселинско-базна хемиска реакција на амонијак со азотна киселина:[3]
HNO3(aq) + NH3(g) → NH4NO3(aq)
Реакцијата е бурна и мошне егзотермна. Откако ќе настане растворот, обично со концентрација од околу 83%, вишокот вода испарува и се добива раствор од амониум нитрат со концентрација од 95% до 99,9%, зависно од чистотата.
Амонијакот за овој процес се добива со Хаберов процес од азот и водород. Амонијакот добиен со Хаберов процес се претвора во азотна киселина преку Оствалдовиот процес. Друг метод на производство е варијанта на Ода процесот:
- Ca(NO3)2 + 2 NH3 + CO2 + H2O → 2 NH4NO3 + CaCO3
Амониум нитрат исто така може да се добие и со раствори на амониумски и нитратни соли:
- (NH4)2SO4 + 2 NaNO3 → Na2SO4 + 2 NH4NO3
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4
Реакции
Амониум нитрат реагира со метални хидроксиди, испуштајќи амонијак и формирајќи алкален метален нитрат:
- NH4NO3 + MOH → NH3 + H2O + MNO3 (M = Na, K)
Амониум нитрат не остава талог кога се загрева:
- NH4NO3 → N2O + 2H2O
Амониум нитрат се создава во атмосферата од испуштање на NO, SO2, и NH3, и е секундарен компонент на ПМ10 честичките.[4]
Примена
Ѓубриво
Амониум нитрат е важно ѓубриво со NPK рејтинг 34-0-0 (34% азот).[5] Тој не е толку концентриран од уреата (46-0-0), па затоа има транспортна неповолност. Предноста на амониум нитратот во однос на уреата е што е постабилен и не испушта толку брзо азот во атмосферата.
Експлозив
Амониум нитратот сам по себе не е експлозив,[6] но формира експлозивни соединенија со различни својства кога се комбинира со примарни експлозиви како азиди или со горива како алуминиумска прашина (танерит) или со течно гориво како нафта (ANFO).
Мешавина со течни горива
ANFO е мешавина од 94% амониум нитрат ("AN") и 6% мазут (fuel oil = "FO") широко употребувано како индустриски експлозив.[7] Се користи во рударството (рудници за ископи на јаглен и метал), во каменоломи и градежништвото. Негови предности во однос на други конвенционални експлозиви се водоотпорност, баланс на кислород, висока брзина на детонација и перформанси на помали пречници.[7]
Remove ads
Влијание врз здравјето
Податоците за здравјето и безбедноста се прикажани на листите за безбедност на материјалите кои се доставуваат од страна на добавувачите и можат да се најдат на интернет.[8]
Амониум нитратот сам за себе не е многу штетен за здравјето и честопати се користи како ѓубриво.[8][9][10] Тој има LD50 of 2217 mg/kg,[11] што за споредба е околу тве третини од готварската сол.
Ракување, складирање и безбедност
Загревање или негово палење може да предизвика силен оган или експлозија.[12] Амониум нитратот реагира со гориво и редуцирачки материјали бидејќи е силен оксиданс. Иако главно се користи за ѓубриво, може да се користи за експлозиви.[13][14] Се користи и да се модифицира степенот на детонација на некои други експлозиви како тринитротолуен во форма на аматол.
Постојат бројни безбедносни мерки за тоа како се ракува и се складира амониум нитрат.[15] Не треба да се чува близу до согорувачки супстанции. Не е компатибилен со некои супстанции како хлорати, неоргански киселини и метални сулфиди што може да доведе до енергични или дури и насилни разградувања.[16]
Амониум нитратот има критична релативна влажност од 59,4%, над која ќе апсорбира влага од атмосферата. Затоа, важно е да се чува во цврсто затворен контејнер. Амониум нитратот може да собере доволно влага до претворање во течна состојба. Мешањето на амониум нитратот со други ѓубрива може да му ја намали критичната релативна влажност[17].
Remove ads
Надворешни врски
- Меѓународна картичка за хемиска безбедност 0216 (англиски)
- "Складирање и ракување со амониум нитрат", Велика Британија, публикација за здравје и безбедност INDG230 (1986)
- Хемиски водич: Безбедно складирање, ракување и работа со амониум нитрат САД, Агенција за заштита и безбедност на околина
- Калкулатори: притисоци на површина Архивирано на 22 февруари 2020 г., и густини, моларност и модалитети Архивирано на 22 февруари 2020 г. на разводнет амониум нитрат
Remove ads
Наводи
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads