Хистон
From Wikipedia, the free encyclopedia
Remove ads
Во биологијата, хистоните се многу алкални белковини кои се наоѓаат во еукариотските клеточни јадра и служат за пакување на ДНК молекулите во структурни единици наречени нуклеозоми.[1][2] Тие се главната белковинска компонента на хроматинот и играат важна улога во регулацијата на експресијата на гените. Без хистоните, релаксираната хромозомска ДНК би била многу долга (односот помеѓу должината и ширината кај човечката ДНК е повеќе од 10 милиони спрема 1). На пример, секоја човечка диплоидна клетка (содржи 23 пара на хромозоми) има количина на ДНК која вкупно има должина од околу 1,8 метри; меѓутоа кога е намотана околу хистонските молекули во форма на хроматин нејзината должина опаѓа на околу 90 микрометри (0.09 mm). Во текот на митозата, кога генетскиот материјал е дуплиран, вкупната должина на хромозомите кај диплоидните келтки изнесува само околу 120 микрометри.[3]
Remove ads
Класи и варијанти
Постојат пет главни хистонски фамилии: H1/H5, H2A, H2B, H3, и H4.[2][4][5][6] Хистоните H2A, H2B, H3 и H4 се познати како основни хистони, додека хистоните H1/H5 се познати како поврзувачки (линкер) хистони.
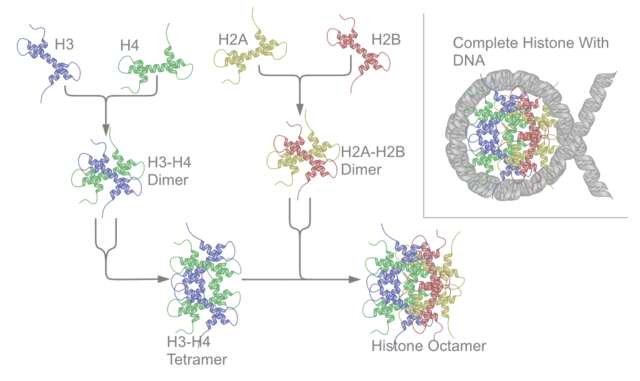
Сите основни хистони постојат како димери, а се слични меѓусебе по тоа што сите го поседуваат истиот белковински домен: три алфа-завојницаа поврзани со две петелки. Токму оваа завојна структура овозможува интеракција помеѓу различните димери, особено по шемата „глава со опаш“ (исто така наречен мотив на ракување).[7] Резултирачките четири различни димери потоа се поврзуваат за да формираат едно октамерно нуклеозомско јадро, кое е околу 63 Ангстреми во пречник. Околу 146 базни парови (бп) на ДНК се намотуваат околу ваквата основна нуклеозомска честичка, 1.65 пати во облик на левогира, суперзавојна структура, за да на крај се добие честичка со пречник од околу 100 Ангстреми.[8] Линкер хистонот H1 се врзува на местото каде се наоѓаат влезната и излезната точка на ДНК молекулата, на тој начин фиксирајќи ја во место[9] и овозможувајќи формирање на структури од повисок ред. Најосновната таква структура е „влакно“ од 10 nm, кое личи на конец со нанижени бисерчиња, а е изградено од два нукеозома одделени со околу 50 базни парови на слободна ДНК (исто така позната како линкер ДНК). Структури од повисок ред ги вклучуваат влакната од 30 nm (кои формираат неправилна цик-цак форма) и влакната од 100 nm кои најчесто се среќаваат во нормалните клетки. За време на митозата и мејозата, кондензираните хромозоми се агрегираат преку интеракции помеѓу нуклеозомите и другите регулаторни белковини.
Хистоните се поделени на канонски репликационо-зависни хистони, чија експресија се одвива за време на S-фазата на клеточниот циклус, и репликационо-независни хистонски варијанти, чија експресија се одвива во текот на целиот клеточен циклус. Кај животинските организми, гените кои кодираат за канонските хистони обично се групирани заедно по должината на хромозомот, немаат интрони и нивните иРНК не подлежат на полиаденилација. Гените кои кодираат за хистонски варијанти обично не се групираат заедно, имаат интрони и нивните иРНК подлежат на полиаденилација. Комплексните повеќеклеточни организми обично поседуваат поголем број на хистонски варијанти што дава поголема разновидност на функциите. Хистонските варијанти од различни видови на организми, нивната класификација и нивните специфични одлики може да се најдат во базата на податоци "HistoneDB 2.0 - Варијанти".
Ова е список на човечки хистонски белковини:
Remove ads
Структура
Јадрото на нуклеозомот е изградено од два H2A-H2B димера и еден H3-H4 тетрамер, со што се формираат две речиси симетрични половини (C2 симетричност; едната макромолекула е како слика во огледало во однос на другата).[8] H2A-H2B димерите и H3-H4 тетрамерот, исто така, покажуваат псевдодијадна симетричност. Овие четири „основни“ хистони (H2A, H2B, H3 и H4) се релативно слични во структура и се високо сочувани во текот на еволуцијата, а сите поседуваат завојница-свиок-завојница-свиок-завојница мотив (ДНК-врзувачки белковински мотив кој препознава специфични ДНК-низи). Тие, исто така, ја споделуваат одликата да поседуваат долги петелки (опашки) на едниот крај од третичната структура, која претставува локација на посттранслационите модификации (види подолу).[10]
Архејските хистони поседуваат само една структура која е слична на H3-H4 димер, а е изградена од истата белковина. Овие димерни структури се насложуваат во една голема суперзавојна структура (супернуклеозом) на која се навива ДНК молекулата, на сличен начин како кај нуклеозомите.[11] Само некои архејски хистони поседуваат опашки.[12]
Хистоните градат пет вида на интеракции со ДНК:
- Завојните диполи од алфа-завојницаите во H2B, H3 и H4 овозможуваат да се акумулира нето позитивен полнеж во точките на интеракција со негативно наелектризираните фосфатни групи на ДНК.
- Водородни врски помеѓу амидните групи од полипептидниот синџир на хистонот и пентозо-фосфатниот синџир на ДНК.
- Неполарни интеракции помеѓу хистонот и деоксирибозата на ДНК.
- Солени мостови и водородни врски помеѓу страничните ланци на базните аминокиселини (особено лизинот и аргининот) и фосфатните кислороди на ДНК.
- Неспецифични вметнувања на N-терминалните опашки на H3 и H2B молекулите во двата мали жлеба на ДНК молекулата.
Исклучително базната природа на хистоните, освен што овозможува интеракции со ДНК, исто така придонесува за нивната висока растворливост во вода.
Хистоните подлежат на посттранслациони модификации главно на нивните N-терминални опашки, но исто така и на нивните глобуларни домени.[13][14] Овие модификации вклучуваат: метилација, цитрулинација, ацетилација, фосфорилација, SUMOилација, убиквитинација и ADP-рибозилација. Ова влијае на нивната функција во регулацијата на експресијата на гените.
Во принцип, гените кои се поактивни и имаат помалку врзани хистони, додека неактивните гени имаат повеќе врзани хистони за време на интерфазата.[15] Структурата на хистоните еволутивно е високо сочувана, бидејќи секоја штетна мутација сериозно би се одразила на способноста на организмот за адаптација. Сите хистони имаат многу позитивно наелектризирани N-терминали, со многу лизински и аргинински остатоци.
Remove ads
Сочуваност кај разните видови на организми
Хистоните се наоѓаат во јадрата на еукариотските клетки, а и во одредени археи, имено Proteoarchaea и Euryarchaea, но се отсутни кај бактериите.[12] Порано се мислело дека едноклеточните алги познати како динофлагелати се единствените еукариоти кои немаат хистони,[16] но поновите истражувања покажале дека нивната ДНК поседува гени за хистони.[17] За разлика од основните хистони, линкер хистоните (H1) богати со лизин се среќаваат кај бактериите, каде се познати како нуклеобелковина HC1/HC2.[18]
Архејските хистони можеби претставуваат еволуциони претходници на еукариотските хистони.[12] Кај еукариотите, хистоните се едни од еволуционо најсочуваните белковини, што ја потенцира нивната централна улога во биологијата на клеточното јадро.[2]:939 Единствено созреаните сперматозоиди главно користат протамини за пакување на нивната геномска ДНК, најверојатно бидејќи на овој начин постигнуваат повисок степен на спакуваност.[19]
Во некои од главните класи постојат варијантни форми. Тие споделуваат хомологија во аминокиселинската низа и структурата со одредена класа на големи хистони, но, исто така, имаат и свои сопствени одлики кои е разликуваат од оние на главните хистони. Овие варијантни форми обично извршуваат специфични функции во метаболизмот на хроматинот. На пример, хистонот CENPA се наоѓа само во регионот на центромерот на хромозомот. Хистонот H2A.Z е поврзан со промоторите на активно транскрибирани гени и, исто така, игра улога во превенцијата на ширењето на тивкиот хетерохроматин.[20] Исто така, H2A.Z има улоги во хроматинот за геномска стабилност.[21] Хистонот H2A.X е фосфорилиран на S139 во регионите околу пресеците на двојната верига на ДНК и го обележува регионот кој е во процес на ДНК поправка.[22] Хистонот H3.3 е поврзан со регионите на активно транскрибирани гени.[23]
Функција
Пакување на ДНК нишките
Хистоните делуваат како калеми околу кои се намотува ДНК молекулата. Пакувањето на ДНК кај еукариотите е неопходно поради големината на нивниот геном: спакуваната ДНК молекула е околу 40.000 пати пократка од неспакуваната.
Хроматинска регулација
Хистоните често подлежат на посттранслациони модификации кои ја менуваат нивната интеракција со ДНК и јадрените белковини. Хистоните H3 и H4 имаат долги опашки кои излегуваат од нуклеозомот, кои може ковалентно да се модифицираат на неколку места. Модификациите на опашката вклучуваат метилација, ацетилација, фосфорилација, убиквитинација, SUMOилација, цитрулинација и ADP-рибозилација. Јадрото на хистоните H2A и H2B, исто така, може да биде изменето. Комбинациите на овие модификации се смета дека претставуваат вид на код, т.н. „хистонски код“.[24][25] Хистонските модификации играат улога во различни биолошки процеси како што се регулацијата на генската експресија, поправката на ДНК, кондензација на хромозомите (митоза) и сперматогенеза (мејоза).[26]
Заедничка номенклатура на хистонските модификации е:
- Името на хистонот (на пример, H3)
- Кратенката на аминокиселината од една буква (на пример, К за лизин) и нејзината позиција во белковината
- Типот на модификација (Ме: метил, P: фосфат, Ac: ацетил, Ub: убиквитин)
- Бројот на модификации (само Me е познато дека се јавува во повеќе од една копија по аминокиселински остаток. 1, 2 или 3 е моно-, ди- или три-метилација)
Пример: H3K4me1 означува монометилација на четвртиот аминокиселински остаток (во овој случај лизин) од почетокот (односно, од N-терминалот) на H3 белковината.
Remove ads
Функции на хистонските модификации

Опишани се голем број на хистонски модификации, но функцијата на повеќето сѐ уште не е доволно разјаснета. Се смета дека сите тие се дел од т.н. „хистонски код“, во кој комбинациите на повеќе модификации имаат специфични значења. Сепак, повеќето функционални податоци се однесуваат на одделни хистонски модификации кои се биохемиски подложни на детално проучување.
Remove ads
Поврзано
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


