Top Qs
Tijdlijn
Chat
Perspectief
Sigma-binding
Van Wikipedia, de vrije encyclopedie
Remove ads
Een sigma-binding of σ-binding is een vorm van covalente binding tussen twee atomen. De sigma-binding wordt gevormd door de orbitaaloverlap van twee atomaire orbitalen tot een moleculair orbitaal, waarbij de elektronendichtheid langs de bindingsas tussen beide atoomkernen geen discontinuïteit vertoont.[1][2] Dientengevolge is de sigma-binding volledig rotatie-symmetrisch volgens de bindingsas. Deze vorm van binding tussen atomen wordt vooral aangetroffen in de organische chemie tussen koolstofatomen in verzadigde verbindingen.
De sigma-binding is het sterkste type binding. De bindingsenergie kan oplopen tot meer dan 500 kJ/mol, bijvoorbeeld voor de silicium-fluor-binding.
Remove ads
Sigma-binding in waterstofgas
Samenvatten
Perspectief
De sigma-binding in waterstofgas H2 komt tot stand door de overlap van de twee 1s-orbitalen op waterstof. Het resultaat van deze overlap is de vorming van twee moleculaire orbitalen, een bindend:
en een antibindend:
Dit kan ook met elektronendensiteitsplots worden voorgesteld:
 |
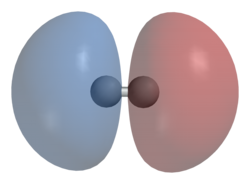 |
| Bindend moleculair orbitaal | Antibindend moleculair orbitaal |
Het bindende en antibindende moleculaire orbitaal worden in waterstofgas ook respectievelijk aangeduid als HOMO en LUMO. Bij het bindende moleculaire orbitaal is de elektronenprobabiliteit het grootst tussen beide atomen. Dit impliceert dat wanneer dit moleculaire orbitaal wordt gevuld met elektronen, er een binding gevormd wordt. Wanneer het moleculair orbitaaldiagram wordt geschetst, dan wordt inderdaad duidelijk dat enkel het bindende moleculaire orbitaal gevuld is met twee elektronen:

De bindingsorde bedraagt dus 1: er wordt 1 covalente binding gevormd tussen beide waterstofatomen. Deze binding is symmetrisch ten opzichte van de bindingsas en wordt dus een sigma-binding genoemd.
Remove ads
Tweede periode-elementen
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

