Top Qs
Tijdlijn
Chat
Perspectief
Koolstof
scheikundig element met symbool C en atoomnummer 6 Van Wikipedia, de vrije encyclopedie
Remove ads
Koolstof (Latijn: carbonium) is een scheikundig element met symbool C en atoomnummer 6. Het is een niet-metaal dat in verschillende vormen, allotropen, voorkomt. In de natuur komen de allotropen diamant, grafiet, amorfe koolstof en het zeldzame lonsdaleïet voor. Fullerenen zijn synthetische vormen van koolstof.
Remove ads
Geschiedenis
Koolstof werd al in de prehistorie ontdekt en gebruikt in de vorm van houtskool, dat werd bereid door organisch materiaal, meestal hout, door middel van pyrolyse zuurstofarm te verhitten. Het Engelse equivalent carbon is dan ook afgeleid van het Latijnse woord voor houtskool.
Diamant, een andere allotroop van koolstof, is al lang bekend. Pas sinds enkele decennia is het mogelijk diamant synthetisch te vervaardigen. Fullereen, een derde allotroop, werd in de jaren 1980 ontdekt, tijdens het bestuderen van het massa-spectrum van een proef, waarbij een laserstraal koolstof deed verdampen.
Het was de Franse scheikundige Antoine Lavoisier die wist dat carbon pur, zuivere koolstof, een chemisch element was. Halverwege de achttiende eeuw was algemeen bekend dat diamant bij hoge temperaturen brandt, maar Lavoisier toonde aan dat het verbrandingsproduct kooldioxide is, wat inhield dat diamant zuivere koolstof is. De Zweedse scheikundige Carl Wilhelm Scheele ontdekte in 1779 dat ook grafiet zuivere koolstof is.
Remove ads
Voorkomen
Koolstof komt natuurlijk voor in de vorm van koolwaterstoffen, met name de fossiele brandstoffen aardgas en aardolie. Uit aardolie wordt in de petrochemische industrie onder andere benzine en kerosine gedestilleerd en verder dient koolstof als basis voor de organische synthese van kunststof.
Toepassingen
Samenvatten
Perspectief
Andere toepassingen zijn:
- Koolstof-14, genoteerd 14C, ontdekt op 27 februari 1940, is een van de isotopen van koolstof. Het wordt gebruikt bij C14-datering.
- Grafiet vormt het "streepvormend" deel in potloden, waarbij ook nog klei wordt toegevoegd voor stevigheid.
- Diamanten, een vorm van zuivere koolstof, vinden toepassing in kostbare sieraden en worden om hun hardheid onder andere toegepast in boorkoppen.
- Bij de productie van staal is koolstof een van de stoffen die met het ijzererts wordt gemengd.
- In kernreactors wordt grafiet in staven toegepast om het kernsplijtingsproces te modereren, ofwel beheersbaar te houden.
- De chemische en structurele eigenschappen van fullerenen maken dat voor deze koolstofcomplexen misschien een veelbelovende rol is weggelegd in de nanotechnologie.
- In fijnverdeelde toestand, als zogenaamde actieve kool, heeft kool een hoog specifiek oppervlak en kan het gebruikt worden als adsorptiemiddel. Het wordt gebruikt als filtermateriaal om vloeistoffen te ontkleuren, en zelfs ingeslikt om gifstoffen uit het maag-darmkanaal te verwijderen ('Norit').
- Elektronicaweerstanden (grafietweerstand); koolstof is weliswaar een goede stroomgeleider, maar een dun laagje grafiet kan als weerstand dienen. Daarbij neemt de weerstand van grafiet met toenemende temperatuur toe: hoe krachtiger de elektrische stroom, hoe hoger de temperatuur, en hoe hoger de weerstand. Grafiet heeft daarbij als voordeel dat het temperatuurverhoging goed doorstaat.
- Koolhydraten als ethanol, sacharose, glucose, fructose, zetmeel.
- Plantaardige oliën en vetten en de verwerking daarvan in voeding en oleochemie.
- Als allerbelangrijkste: het element koolstof is onmisbaar voor alle levende wezens: alle organische verbindingen bevatten het element koolstof.
- Formule 1-auto's zijn van koolstofvezel gemaakt
Opmerkelijke eigenschappen
Samenvatten
Perspectief
Koolstof is een vierwaardig element dat in grote hoeveelheden op aarde voorkomt. Het heeft de unieke eigenschap zich stabiel met andere koolstofatomen te kunnen binden tot ringen en ketens, vertakt of onvertakt.
De vier belangrijkste allotropen van koolstof zijn:
- grafiet, een van de zachtst bekende vaste stoffen, met een hardheid van 1,5 maar, in de vorm van koolstofvezel, wel met een hoge treksterkte;
- diamant, het hardst bekende natuurlijke mineraal, met een hardheid van 10,0 op de hardheidsschaal van Mohs;
- amorfe koolstof;
- fullerenen, synthetische holle structuren met elektrochemische eigenschappen, die interessant zijn voor toepassing in de nanotechnologie.
Daarnaast zijn er exotischere vormen ontdekt zoals lonsdaleïet, glasachtig koolstof en starre, rechte ketens als 'carbyne', met afwisselend enkelvoudige en drievoudige bindingen, en cumuleen, met alleen dubbele bindingen.
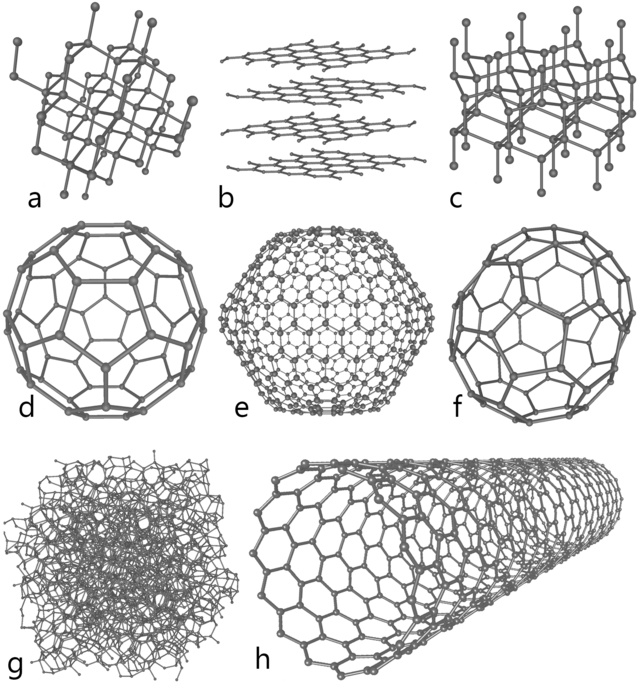
Bij normale druk vormt koolstof grafiet. Hierbij vormt elk koolstofatoom bindingen met drie andere koolstofatomen. Deze verbindingen liggen alle in hetzelfde vlak, dat bestaat uit gefuseerde hexagonale ringen, net als bij aromatische koolwaterstoffen. De twee bekende vormen van grafiet, alfa-hexagonaal en bèta-rombohedraal, hebben identieke fysische eigenschappen, maar verschillen in hun kristalstructuur. Natuurlijk grafiet kan tot 30% uit de bètavorm bestaan. Synthetisch grafiet bevat alleen de alfavorm. De alfavorm kan overgaan in de bètavorm door mechanische behandeling. Boven 1000 °C gaat de bètavorm weer over in de alfavorm.
Grafiet geleidt elektriciteit, dankzij de delokalisatie van het p-orbitaal. Grafiet is zeer zacht en bestaat uit lagen die makkelijk over elkaar heen glijden, doordat de chemische binding tussen de lagen uit de relatief zwakke vanderwaalskrachten bestaat. De sterkte binnen iedere afzonderlijke laag is wel groot, een eigenschap die bij koolstofvezels - 'linten' van grafiet - tot uiting komt.
Bij zeer hoge druk kan de tweede allotrope vorm van koolstof, diamant, ontstaan. In diamant vormt elk koolstofatoom covalente bindingen met vier andere koolstofatomen. Diamant heeft dezelfde kubische kristalstructuur als silicium en germanium. De sterkte van de koolstof-koolstofbindingen maken diamant, samen met het iso-elektronische boornitride, de hardst bekende verbindingen, die uiterst krasbestendig zijn.
Bij kamertemperatuur verloopt de faseovergang van grafiet naar diamant extreem traag. Onder sommige omstandigheden kristalliseert koolstof als Lonsdaleïet, een vorm die overeenkomsten vertoont met diamant, maar hexagonaal is.
Koolstof komt in zeer veel verschillende chemische verbindingen voor, in alle organische levensvormen, en vormt de basis voor de organische chemie. Koolstof heeft de interessante eigenschap dat het covalente bindingen met zichzelf en talloze andere elementen kan aangaan, het aantal mogelijke koolstofverbindingen is theoretisch onbeperkt. Koolstof vormt in verbinding met zuurstof onder andere CO2, dat via fotosynthese essentieel is voor plantengroei. In verbinding met waterstof vormt het zogenaamde koolwaterstoffen. Hiertoe behoren ook de vetzuren, waarvan vele onmisbaar zijn voor het leven. Ook worden veel koolwaterstoffen in de aardkorst als fossiele brandstoffen aangetroffen.
Koolstof is om vele redenen een bijzonder element. Het vormt zowel een van de zachtste bekende materialen (grafiet), als een van de hardste (diamant). Koolstof gaat gemakkelijk verbindingen aan met veel andere kleine atomen, waaronder andere koolstofatomen. Er zijn zo'n 10 miljoen koolstofverbindingen bekend. Koolstofverbindingen vormen de basis voor al het leven op aarde. De koolstof-stikstofcyclus is een van de processen die in de zon en andere sterren energie levert.
Koolstof werd niet gevormd bij het ontstaan van het heelal, tijdens de oerknal, doordat er drie botsingen tussen alfadeeltjes (heliumkernen) nodig zijn om koolstof te vormen. Het heelal koelde daarvoor in het begin te snel af. De vorming van koolstof vindt voornamelijk in de hete sterren plaats.
Fullerenen zijn genoemd naar de architect Buckminster Fuller, die soortgelijke constructies in architectonische ontwerpen introduceerde, en worden om dezelfde reden ook wel "buckyballs" en "buckytubes" genoemd. Fullerenen hebben een grafietachtige structuur maar, naast een zuivere hexagonale opeenstapeling, komen er ook pentagonale en mogelijk heptagonale ordeningen van koolstofatomen in voor, waardoor de lagen zich vormen tot bollen, ellipsen en cilinders. Aan de materiaaleigenschappen van fullerenen valt nog veel te ontdekken.
Remove ads
Verschijning
Er zijn als gezegd zo'n 10 miljoen koolstofverbindingen bekend. Koolstof komt in grote hoeveelheden voor in sterren - waaronder de zon, in kometen, en in de atmosfeer van veel planeten. Sommige meteorieten bevatten microscopisch kleine diamanten die gevormd zijn toen het zonnestelsel nog een protoplanetaire schijf was.
Koolstof komt in diverse verbindingen voor in de aardatmosfeer (als koolzuurgas), in water (als koolzuur), op de zeebodem (methaanhydraat) en in de aardkorst (steenkool, aardolie). In combinatie met kleinere hoeveelheden calcium, magnesium en ijzer komt koolstof op aarde ook in grote hoeveelheden voor in carbonaat en rotsgesteenten als kalksteen, dolomiet, marmer, etc.
Economische winning van grafiet vindt vooral plaats in China, India, Brazilië, Noord-Korea en Canada.[2]
Natuurlijke diamanten worden gevonden in oude vulkanische gesteenten, opgesloten in het mineraal kimberliet. De meeste diamanten worden gedolven in Afrika, vooral in Zuid-Afrika, Namibië, Botswana, Congo-Brazzaville en Sierra Leone. Verder worden diamanten gevonden in Canada, de Russische Poolzee, Brazilië en in Noord- en West-Australië.
Remove ads
Isotopen
Er zijn verschillende isotopen van koolstof.
Het element komt op aarde van nature als twee stabiele isotopen voor: 12C en 13C. Daarnaast is er een radioactief isotoop 14C (Koolstof 14) dat in de atmosfeer voortdurend aangemaakt wordt door kernreacties ten gevolge van de kosmische straling. Koolstof-14-datering wordt veel gebruikt om archeologische vondsten te dateren.
Remove ads
Ionen
Strikt genomen komen er van koolstof geen vrije ionen voor, van koolstof zijn echter wel diverse oxidatiegetallen bekend.
Remove ads
Toxicologie en veiligheid
Koolstof wordt (beperkt) gebruikt als voedseladditief. In de EU is dit toegestaan onder E-nummer E153.
Roetuitstoot door onder andere het verkeer bestaat voor een belangrijk deel uit koolstof. Koolstof is daarmee een component van fijnstof.
Naast de talloze koolstofverbindingen zonder welke het leven op aarde niet mogelijk zou zijn, zijn er ook veel toxische koolstofverbindingen, waaronder:
- koolstofmonoxide (CO) dat onder andere voorkomt in uitlaatgassen van verbrandingsmotoren;
- het cyanide-ion (CN−), dat soms in mijnen wordt aangetroffen, maar ook een belangrijke toepassing heeft bij de productie van polymeren als polyurethaan.
Organische gassen zoals etheen (CH2=CH2) en methaan (CH4) zijn explosief en brandbaar wanneer ze met lucht (zuurstof) gemengd zijn.
- Vrijwel alle niet-ionaire koolstofverbindingen zijn in meer of mindere mate brandbaar.
Remove ads
Overzicht van koolstof-elementverbindingen
Door de centrale plaats die koolstof in de organische chemie inneemt, en het feit dat het, net als zuurstof, met een groot aantal elementen directe bindingen kan aangaan, zijn de verschillende koolstof-elementverbindingen ook zelf uitgebreid onderwerp van studie geworden. In onderstaande tabel zijn de verwijzingen naar de verschillende studiegebieden in het periodiek systeem opgenomen.
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | CAr | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| Standaard verbinding in de organische chemie | Ruime toepassingen in de chemie |
| Academisch interessant, maar beperkte toepassing | Binding onbekend of niet beschreven |
Zie ook
Externe links
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

