Top Qs
Tijdlijn
Chat
Perspectief
Virologie
wetenschap die zich bezighoudt met virussen en virusziekten Van Wikipedia, de vrije encyclopedie
Remove ads
De virologie is de wetenschap die zich bezighoudt met virussen en virusziekten. Het is een deelgebied van de microbiologie en richt zich op de structuur, genetica, classificatie en evolutie, verspreiding, en de moleculaire werking van virussen. Virologen onderzoeken onder meer hoe virussen cellen infecteren en zich daar vermenigvuldigen, hoe ze het immuunsysteem ontwijken, en hoe ze ziekten veroorzaken in hun gastheer. Er zijn verschillende technieken om virussen in het laboratorium te isoleren, te kweken en waar te nemen.

De ontdekking van de veroorzaker van de tabaksmozaïekziekte door de Nederlandse microbioloog Martinus Beijerinck (1898) markeerde het begin van de virologie als zelfstandige discipline. Hij bewees dat de ziekteverwekker geen bacterie of schimmel was, maar iets totaal anders. Hij kwam tot de conclusie dat het een zelfreplicerend deeltje moest zijn dat veel kleiner en eenvoudiger was dan een bacterie, en introduceerde hierbij de term virus.
De virologie ontwikkelde zich in een tijd waarin er nog geen methoden waren om virussen te testen, te kweken of zichtbaar te maken. Tegenwoordig hebben onderzoekers tal van moleculaire technieken tot hun beschikking om de structuur en functies van virussen en hun samenstellende delen – de virale nucleïnezuren (RNA of DNA) en eiwitten – nauwkeurig te analyseren. Er zijn inmiddels duizenden verschillende virussen bekend; niet alleen bij de mens, maar ook bij dieren, planten en bacteriën. Medische virologen zijn gespecialiseerd in de diagnose, behandeling en preventie van virale infectie bij mensen.
Remove ads
Geschiedenis
Samenvatten
Perspectief

De virologie is een relatief jonge wetenschappelijke discipline. De beginselen van de virologie gaan terug tot de late 19e eeuw. Een belangrijke rol speelde de Russische bioloog Dmitri Ivanovski en Nederlandse microbioloog Martinus Beijerinck, die onafhankelijk van elkaar ontdekten dat de veroorzaker van een ziekte bij tabaksplanten geen bacterie was, maar iets kleiners en simpelers. Ze gebruikten hiervoor een speciaal filter dat ontworpen was om bacteriën tegen te houden.[1] Beijerinck en Ivanovski worden beschouwd als de belangrijkste grondleggers van de virologie.[2][3]
De vermoedens werden bevestigd in 1935 toen Wendell Stanley het besmettelijke deeltje, dat tegenwoordig bekend is als het tabaksmozaïekvirus, kristalliseerde en de eigenschappen ervan verder beschreef. Niet lang daarna werd de elektronenmicroscoop uitgevonden en konden virussen voor het eerst zichtbaar gemaakt worden.[1] Duidelijk werd dat virussen omgeven zijn door een manteltje van eiwitten en net als levende organismen een nucleïnezuur hebben waarin genetische informatie vastligt.[4]
Vanaf de tweede helft van de 20e eeuw werden duizenden nieuwe virussen ontdekt. Het meeste onderzoek werd verricht naar bacteriofagen, maar ook veel planten- en dierenvirussen kregen een naam en beschrijving. In 1963 werd het hepatitis B-virus ontdekt door Baruch Blumberg, en in 1965 beschreef Howard Martin Temin het eerste retrovirus. Het enzym reverse-transcriptase, dat retrovirussen gebruiken voor hun vermenigvuldiging, werd ontdekt in 1970. In 1983 isoleerde het team van Luc Montagnier voor het eerst het retrovirus dat nu bekendstaat als hiv.[5]
Remove ads
Detectie van virussen
Samenvatten
Perspectief
Virussen zijn onzichtbaar onder de normale lichtmicroscoop. In de loop van de twintigste eeuw werden verschillende manieren ontwikkeld om virussen zichtbaar te maken, of hun aanwezigheid in een onderzoeksmonster aan te tonen. Virussen zijn direct waar te nemen met behulp van de elektronenmicroscoop, en kunnen daarnaast gedetecteerd worden door aantoning van de eiwitten (antigenen) of nucleïnezuren waaruit ze bestaan.
Elektronenmicroscopie

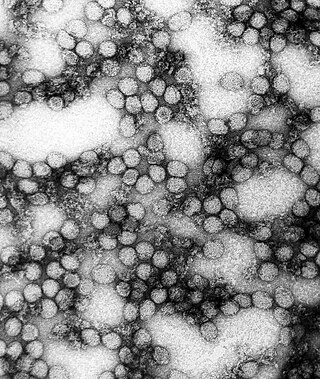
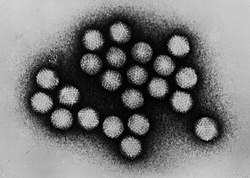
Virussen konden voor het eerst in de jaren 1930 gevisualiseerd worden dankzij de uitvinding van de elektronenmicroscoop – een instrument dat niet gebruikmaakt van lichtgolven maar van een bundel van elektronen om zeer kleine structuren zichtbaar te maken. Met de elektronenmicroscoop werd het mogelijk om objecten op de atomaire schaal in beeld te krijgen.
Om virusdeeltjes zichtbaar te maken ten opzichte van de achtergrond, worden ze gecontrasteerd met een speciale kleuringstechniek genaamd negative staining. Hierbij worden de virussen gesuspendeerd in een oplossing van metaalzouten zoals uranylacetaat of wolfraam. Deze stoffen verstrooien de elektronen, zodat het virusdeeltje digitaal wordt afgetekend. Met behulp van negatiefgekleurde elektronenmicroscopie zijn in de loop der jaren veel virussen ontdekt, en hoewel de techniek al oud is, is het nog steeds een krachtige karakteriseringsmethode in de moderne virologie.[6]
Elektronenmicroscopie is onder meer van belang bij virusidentificatie, de diagnostiek van virusziekten, bepaling van de uitwendige structuur (morfologie), en onderzoek naar de mechanismen van aanhechting aan gastheercellen en replicatie.[6] In recente decennia zijn er grote stappen gemaakt om de resolutie te verbeteren. Informatie over de structuur van het virusdeeltje kan van groot belang zijn voor de ontwikkeling van nieuwe antivirale geneesmiddelen of vaccins.[7]
Een relatief vernieuwende vorm van elektronenmicroscopie is cryogene elektronenmicroscopie (cryo-EM). Deze techniek maakt gebruik van extreem snelle bevriezing van het monster in een cryogene oplossing. Dit heeft als voordeel dat de eiwitstructuren niet aangetast worden en het virusdeeltje in zijn oorspronkelijke, driedimensionale staat bekeken kan worden. Het wordt vooral toegepast om de structuur van de capside en het virusenvelop te ontrafelen – bij traditionele elektronenmicroscopen kunnen deze structuren gedeformeerd raken.
- Opnames van virussen met de transmissie-elektronenmicroscoop
- Een groepje adenovirussen
- Het coronavirus SARS-CoV-2
- Het pleiomorfe rubellavirus
PCR en detectie van virale nucleïnezuren
PCR is een standaardtechniek in de moleculaire biologie, waarmee men een specifiek stukje genetisch materiaal kan vermenigvuldigen voor analyse en onderzoek. In de virologie wordt het veel gebruikt om virussen op te sporen, in het bijzonder om besmettingen aan te tonen (diagnostiek). Tijdens de PCR-reactie wordt een deel van het genetisch materiaal van het virus (DNA of RNA) via vele thermische cycli vermenigvuldigd, zodat het meetbaar wordt. Als het vermenigvuldigde fragment na een bepaald aantal cycli boven een grenswaarde uitstijgt, kan men met zekerheid zeggen dat de betreffende virussoort in het onderzoeksmonster aanwezig is. De kracht van de PCR-techniek zit hem vooral in de specificiteit en enorme gevoeligheid: al een paar moleculen DNA of RNA zijn voldoende voor het uitslaan van de test.[8]
PCR is in diagnostische laboratoria volledig geautomatiseerd, waardoor het zeer geschikt is om op grote schaal besmettingen in kaart te brengen. Als er plotseling een nieuw besmettelijk virus opduikt, zoals in 2020 gebeurde met het coronavirus SARS-CoV-2, kan er relatief snel een specifieke PCR-test worden bedacht, zolang de sequentie van het virale genoom is bepaald en unieke gebieden van het virale DNA of RNA zijn geïdentificeerd.[9] Deze gebieden kunnen dan worden gebruikt voor de specifieke detectie van het pathogene virus.
Remove ads
Kweek van virussen
Samenvatten
Perspectief

Een virusdeeltje kan zich niet zelfstandig voortplanten. Om zich te repliceren (vermenigvuldigen) moet een virus gebruikmaken van de stofwisseling en machinerie van een levende gastheercel. Virussen kunnen in het laboratorium gekweekt worden met behulp van celculturen. Een vatbare cellijn wordt daarbij besmet met een virussuspensie. De virussen zullen de cellen ingaan en zich daar – gedurende enkele uren of dagen – vele malen vermenigvuldigen. De replicatie kan worden gevolgd door biochemische testen, of door regelmatig het aantal infectieuze virusdeeltjes in het kweekmedium te bepalen.
Vaak is aan de celcultuur te zien of deze geïnfecteerd is, voornamelijk door de (schadelijke) effecten die virussen hebben op hun gastheercellen. Deze zogenaamde cytopathische effecten zijn vaak kenmerkend voor het type virus. Herpes-simplexvirussen produceren bijvoorbeeld een karakteristieke ballonvorming van de cellen, bijvoorbeeld in menselijke fibroblasten. Sommige coronavirussen zorgen ervoor dat cellen samensmelten tot een syncytium. Ook dit duidt op infectie.
Kwantificatie
In de virologie is het vaak belangrijk om de concentratie van virusdeeltjes in een virussuspensie te weten. Een belangrijke manier om dit te bepalen is de plaque assay. De kracht van deze methode is dat men specifiek kijkt naar het aantal infectieuze (biologisch actieve) virusdeeltjes. Er zijn ook andere kwantitatieve methoden die uitwijzen hoeveel viraal genetisch materiaal of virale eiwitten er in een monster aanwezig zijn, maar hierbij telt men ook de defectieve deeltjes mee.

Bij een plaque assay wordt eerst een verdunningsreeks gemaakt van de te bepalen virussuspensie (stock). Elk van de verdunningen wordt vervolgens toegevoegd aan een confluente monolaag van gastheercellen in petrischaaltjes. De virussen zullen de cellen infecteren, zich vermenigvuldigen, en uiteindelijk de cel via lyse verlaten. Na een uur incubatie wordt de cellaag bedekt met een halfvast laagje medium (zoals agar), wat ervoor zorgt dat de nieuw-gevormde virusdeeltjes alleen naburige cellen infecteren. Na verloop van tijd leidt dit tot een discreet, telbaar aantal 'gaatjes' van dode cellen in de celcultuur: de zogenaamde plaques.[10]
Met behulp van een kleuring worden de plaques goed zichtbaar: alleen de levende cellen kleuren aan, de dode of gelyseerde cellen blijven wit. Plaques worden vaak handmatig geteld, en in combinatie met de verdunningsfactor kan de titer van de oorspronkelijke virusstock worden berekend (pfu/mL). Deze kwantificatie is gebaseerd op de aanname dat elke gevormde plaque één infectieus virusdeeltje vertegenwoordigt.[10]
Remove ads
Vaccins en medicijnen
Tegen verscheidene virusziekten, zoals griep kan iemand beschermd worden door vaccinatie. Sommige vaccinaties geven geen levenslange immuniteit (zoals bij de griep).
Ter voorkoming van besmetting of tegengaan van de vermenigvuldiging in de gastheer kunnen antivirale middelen toegepast worden, zoals bij hiv, vogelgriep of griep.
Toepassing in de biotechnologie
Samenvatten
Perspectief
Bij de genetische modificatie kunnen in principe ook twee soorten virussen die, anders dan de meeste virussen, hun genetische informatie in dubbelstrengs DNA hebben opgeslagen, voor de overdracht van genetisch materiaal van het ene naar het andere organisme gebruikt worden. Deze methode is echter nog in ontwikkeling.
Gentherapie
Op dit moment zijn virussen de meest gebruikte vectoren bij gentherapie. Vaak zijn dit adenovirussen, die bij mensen verkoudheid veroorzaken, soms zijn het retrovirussen, en ook wordt geëxperimenteerd met 'adenovirus-associated virus'.
Virussen zijn gespecialiseerd in het binnendringen van cellen en het daar inbouwen van hun genen. Dit betekent dat wanneer een therapeutisch gen in een virus wordt 'ingepakt', het virus het inbouwt in het DNA van de patiënt. De genoverdracht wordt zo blijvend gemaakt en is dus in principe levenslang. Uit onderzoek is gebleken dat genoverdracht met behulp van virussen vaak redelijk effectief is, waardoor genoeg lichaamscellen behandeld worden om een aandoening te genezen. Daarnaast kunnen virussen zo bewerkt worden, dat ze maar één type cel herkennen en infecteren. Op die manier kan dus ook een bepaalde precisie bereikt worden.
Remove ads
Zie ook
Bronnen
- (en) Campbell et al, p. 609.
- (en) Bos, L (2000). 100 years of virology: from vitalism via molecular biology to genetic engineering. Trends in Microbiology 8 (2): 82-87. DOI: S0966-842X(99)01678-9.
- (en) Stanley WM, Lauffer MA (1939). Disintegration of tobacco mosaic virus in urea solutions. Science 89 (2311): 345–347. PMID 17788438. DOI: 10.1126/science.89.2311.345.
- (en) Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT (1983). Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 220 (4599): 868–71. PMID 6189183. DOI: 10.1126/science.6189183.
- (en) Goldsmith C, Miller S. (2009). Modern Uses of Electron Microscopy for Detection of Viruses. Clinical Microbiology Reviews. DOI: 10.1128/CMR.00027-09.
- (en) Earl L, Subramaniam S. (2016). Cryo-EM of viruses and vaccine design. PNAS. DOI: 10.1073/pnas.1609721113.
- (en) Watzinger F, Ebner K, Lion T. (2006). Detection and monitoring of virus infections by real-time PCR. Molecular Aspects of Medicine 27 (2-3): 254-298. DOI: 10.1016/j.mam.2005.12.001.
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads